Verschil tussen Valency en Valence Electrons | Valence vs Valence Electrons
Belangrijkste verschillen - Valence vs Valence Electrons
Valence-elektronen en valence-elektronen zijn interverwante termen en het sleutelverschil tussen valentie en valence-elektronen wordt het best uitgelegd in hun definities; valenceelektronen zijn de elektronen in de buitenste schaal van een element terwijl valentieelektronen het aantal elektronen zijn dat moet worden geaccepteerd of verwijderd om de dichtstbijzijnde edelgasconfiguratie te bereiken. Het zijn de elektronen in de buitenste schelp die gewoonlijk bijdragen tot het vormen van chemische bindingen. In sommige atomen is het aantal valence-elektronen gelijk aan het aantal valentie-elektronen.
Wat zijn Valence Electrons? Het aantal elektronen in de buitenste schaal van een atoom heet "valence-elektronen". Om deze reden wordt de buitenste schil van een atoom genaamd "valence shell". Meestal zijn dit de elektronen die deelnemen aan chemische binding. Wanneer elementen kationen vormen, verwijdert ze elektronen uit de valenschaal. Het aantal valence-elektronen in een element bepaalt de groep in de periodieke tabel.

Het aantal elektronen dat nodig is om de buitenste schil van een atoom te krijgen of te verliezen, heet "valentie-elektronen". Voor een bepaald atoom hangt het aantal valentieelektronen af van het aantal valentieelektronen in het atoom. Voor natrium is valentie gelijk aan 1, omdat het het laatste elektron in de buitenste schaal verwijdert om de octetstructuur van het dichtstbijzijnde edelgas te bereiken.
|
Definitie van Valence en Valence Electrons
Valence Electrons:
De elektronen in de buitenste schaal van een atoom worden "valence-elektronen" genoemd. Voor "s" en "p" groep elementen is het aantal valence-elektronen gelijk aan hun groepsnummer. Voorbeeld
Valence Electrons:
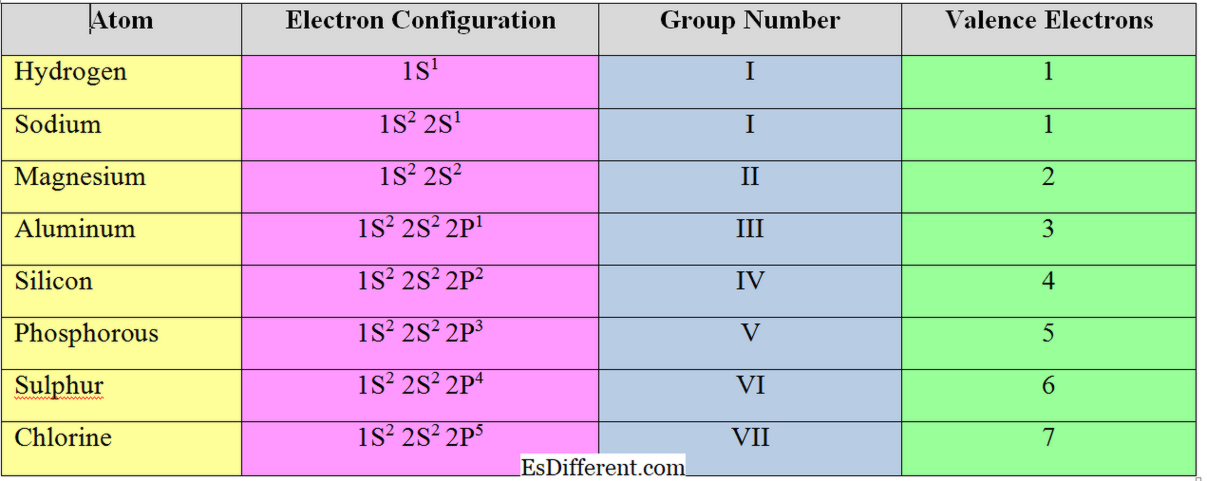
Het aantal elektronen dat moet worden geaccepteerd of verwijderd om de elektronenconfiguratie van het dichtstbijzijnde edelgas te bereiken, heet "valentieelektronen" of de "valentie" van een atoom. In het algemeen is voor metaalelementen (elementen in groep I, II en III) het aantal valence-elektronen gelijk aan het aantal valentie-elektronen; ze verwijderen de elektronen in de valence shell om de octetstructuur te bereiken.
Maar niet-metalen elementen accepteren elektronen om de elektronconfiguratie van het dichtstbijzijnde edelgas te bereiken. Daarom wordt de valentie van niet-metaalelementen berekend door de totale valenceelektronen van 8 te trekken.
Voor Chloor, Aantal valentie-elektronen = 8-7 = 1
Kenmerken van Valentie en Valence-elektronen

Valentie en Valence-elektronen van groep VIII-elementen
Valence-elektronen:
Groep VIII-elementen zijn de edele gassen en zijn chemisch stabiel. Hun buitenmantel is compleet en bevat acht elektronen in de buitenste schil (behalve Helium-He); zodat de groep VIII-elektronen acht valence-elektronen hebben. Valence Electrons:
Valentie is een maat voor het vermogen om bindingen te vormen met andere elementen of moleculen. Edele gassen accepteren of verwijderen geen elektronen om de octetregel te bereiken omdat ze de laatste shell al hebben voltooid. Daarom is de valentie van groep VII elementen gelijk aan nul. Image Courtesy:
"Electron shell 010 Neon - geen label" per commons: Gebruiker: Pumbaa (oorspronkelijke werk door commons: Gebruiker: Greg Robson) - // commons. wikimedia. org / wiki / Categorie: Electron_shell_diagrams (bijbehorende gelabelde versie). (CC BY-SA 2. 0 uk) via Commons




