Verschil tussen ionische en covalente verbindingen | Ionische vs covalente verbindingen
Belangrijkste verschillen - Ionische vs covalente verbindingen
Er kunnen veel verschillen worden aangetroffen tussen ionische en covalente verbindingen op basis van hun macroscopische eigenschappen, zoals oplosbaarheid in water, elektrische geleidbaarheid, smeltpunten en kookpunten. De belangrijkste reden voor deze verschillen is het verschil in hun bindingpatroon. Daarom kan hun bindingspatroon worden beschouwd als het sleutelverschil tussen ionische en covalente verbindingen. (Verschil tussen ionische en covalente bindingen) Wanneer ionische bindingen worden gevormd, wordt elektronen gesubsidieerd door een metaal en gesonueerde elektronen (en) worden door een niet-metaal geaccepteerd. Ze vormen een sterke band door de elektrostatische aantrekkingskracht. Covalente bindingen worden gevormd tussen twee niet-metalen. Bij covalente binding delen twee of meer atomen elektronen om de octetregel te bevredigen. In het algemeen zijn ionische bindingen sterker dan covalente bindingen. Dit leidt tot de verschillen in hun fysieke eigenschappen.
Wat zijn ionische verbindingen?
Ionische bindingen worden gevormd wanneer twee atomen een groot verschil hebben in hun elektronegativiteitswaarden. In het proces van bindingsvorming, krijgen de minder elektronenegatieve atoomverliezen elektronen (en) en meer electronegatief atoom die elektronen (en). Derhalve zijn de resulterende soorten tegenover elkaar geladen ionen en vormen ze een binding als gevolg van de sterke elektrostatische aantrekkingskracht.
Ionische bindingen worden gevormd tussen metalen en niet-metalen. In het algemeen hebben metalen niet veel valence-elektronen in de buitenste schaal; echter, niet-metalen hebben dichter bij acht elektronen in de valence shell. Daarom hebben niet-metalen de neiging om elektronen te accepteren om de octetregel te bevredigen.
Voorbeeld van ionische verbinding is Na + + Cl - NaCl
Natrium (metaal) heeft maar één valence-elektron en Chloor (niet-metaal) zeven valence-elektronen.

Wat zijn covalente verbindingen?
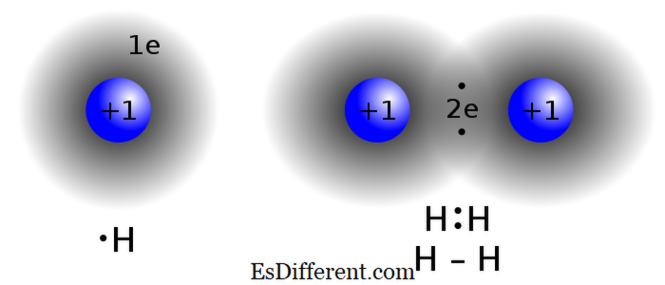
Covalente verbindingen worden gevormd door elektronen tussen twee of meer atomen te delen om de "octetregel" te bevredigen. Dit bindingstype komt vaak voor in niet-metaalverbindingen, atomen van dezelfde verbinding of nabijgelegen elementen in de periodieke tabel. Twee atomen die bijna dezelfde electronegativiteitswaarden hebben, wisselen geen elektronen uit (doneren / ontvangen) van hun valenschaal. In plaats daarvan delen ze elektronen om octetconfiguratie te bereiken.
Voorbeelden van covalente verbindingen zijn Methaan (CH 4 ), Koolmonoxide (CO), Jodiummonobromide (IBr) Covalente Bonding
Wat is het verschil tussen Ionische en Covalente verbindingen?
Definitie van ionische verbindingen en covalente verbindingen
Ionische verbinding:
Ionische verbinding is een chemische verbinding van kationen en anionen die samen gehouden worden door ionische bindingen in een roosterstructuur. Covalente verbinding:
Covalente verbinding is een chemische binding gevormd door het delen van een of meer elektronen, in het bijzonder paren elektronen, tussen atomen. Eigenschappen van ionogene en covalente verbindingen
Fysische eigenschappen
Ionische verbindingen:
Alle ionische verbindingen bestaan als vaste stoffen bij kamertemperatuur.
Ionische verbindingen hebben een stabiele kristalstructuur. Daarom hebben ze hogere smeltpunten en kookpunten. De aantrekkingskracht tussen positieve en negatieve ionen is zeer sterk.
- diff Artikel Midden voor tafel ->
Ionische verbinding| Verschijning | Smeltpunt | NaCl - Natriumchloride |
| Witte kristallijne vaste stof | 801 ° C | KCl - Kaliumchloride |
| Wit of kleurloos glasachtig kristal | 770 ° C | MgCl |
| 2 - Magnesiumchloride Witte of kleurloze kristallijne vaste stof | 1412 ° C | Covalente verbindingen: Covalente verbindingen bestaan in alle drie de vormen; als vaste stoffen, vloeistoffen en gassen bij kamertemperatuur. |
Hun smelt- en kookpunten zijn relatief laag vergeleken met de ionische verbindingen.
Covalente verbinding
Verschijning
| Smeltpunt | HC1-Waterstofchloride | Een kleurloos gas |
| -114. 2 ° C | CH | 4 |
| -Methaan Een kleurloos gas -182 ° C | CCl | 4 |
| - Koolstoftetrachloride Een kleurloze vloeistof < -23 ° C Conductiviteit | Ionische verbindingen: | Vaste ionische verbindingen hebben geen vrije elektronen; daarom voeren ze geen elektriciteit in vaste vorm. Maar wanneer ionische verbindingen in water worden opgelost, maken ze een oplossing die elektriciteit verricht. Met andere woorden, waterige oplossingen van ionische verbindingen zijn goede elektrische geleiders. |
Covalente verbindingen:
Geen zuivere covalente verbindingen noch opgeloste vormen in water leiden geen elektriciteit. Daarom zijn covalente verbindingen slechte elektrische geleiders in alle fasen. Oplosbaarheid
Ionische verbindingen: De meeste ionische verbindingen zijn oplosbaar in water, maar ze zijn onoplosbaar in niet-polaire oplosmiddelen.
Covalente verbindingen:
De meeste covalente verbindingen zijn oplosbaar in niet-polaire oplosmiddelen, maar niet in water. Hardheid
Ionische verbindingen: Ionische vaste stoffen zijn harder en brosse verbindingen.
Covalente verbindingen:
In het algemeen zijn covalente verbindingen zachter dan ionische vaste stoffen. Image Courtesy: "Covalent bond hydrogen" van Jacek FH - Eigen werk. (CC BY-SA 3. 0) via Commons "IonicBondingRH11" door Rhannosh - Eigen werk. (CC BY-SA 3. 0) via Wikimedia Commons


