Verschil tussen Acid-Base Titration en Redox Titration | Acid-Base Titration vs Redox Titration
Belangrijkste verschil - Acid-Base Titration vs Redox Titration
In het algemeen, Titraties worden gebruikt om de concentratie van een onbekende oplossing (analyt) te bepalen. De meest gebruikte twee titrimetrische methoden zijn zuur-base titraties en redox titraties. Het sleutelverschil tussen acid-base titraties en redox titraties is de aard van de reactie die tussen titrant en analyt gebeurt bij de titratie. Bij acid-base titraties vindt een neutralisatiereactie plaats en bij redoxtitraties vindt een redox reactie plaats (een oxidatie reactie en een reductie reactie). Het gebruik van indicatoren is de meest gebruikte methode om het eindpunt van de reactie te bepalen.
Wat is een acid-base titratie?
Bij acid-base titraties wordt een zuur (zure titraties) of een basis (basistitraties) gebruikt als de titrant. Voorbeelden van zuren die gebruikt worden bij zure titraties zijn H 2 SO 4 , HC1 of HNO 3. Meest gebruikte basistitranten zijn NaOH, K 2 CO 3 of Na 2 CO 3. Acid-base titraties kunnen als volgt worden ingedeeld, afhankelijk van de sterkte van het zuur en de base.
Sterke zuren - sterke basistitraties- Sterke zure zwakke basistitraties
- Zwak zuur - sterke basistitraties
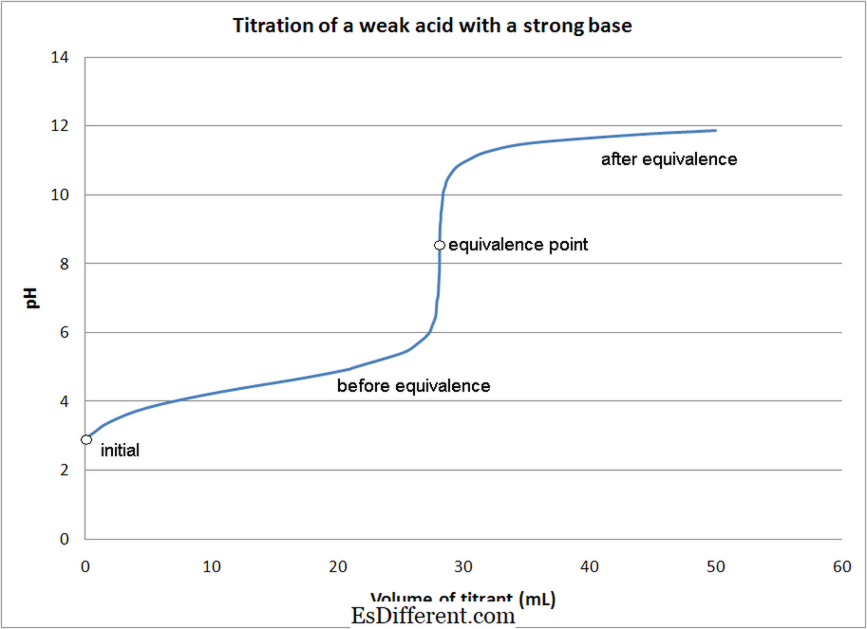
- Zwak zuur - zwakke basistitraties
- In de meeste zuur -base titraties, worden indicatoren gebruikt om het eindpunt van de reactie te bepalen. Verschillende indicatoren worden gebruikt, afhankelijk van het type titratie zoals hierboven vermeld.
Een redoxtitratie houdt in dat er een redox reactie plaatsvindt. Redox reactie heeft twee reacties; een oxidatie reactie en een reductie reactie. Beide oxidatie- en reductieprocessen vinden tegelijkertijd plaats, waardoor we de voltooiing van de reactie kunnen bepalen. Dit staat ook bekend als het eindpunt van de titratie. Dit kan op verschillende manieren worden bepaald; met indicatorelektroden, redox-indicatoren (de indicator geeft een andere kleur bij oxidatie-reductietoestand), en niet-redox-indicatoren (indicator geeft een kleur wanneer een overmaat hoeveelheid titrant wordt toegevoegd).
Wat is het verschil tussen Acid-Base Titration en Redox Titration?

Aard van de reactie:
Zure-base-titratie:
Een zuurbasistitratie houdt in dat er een neutraliseringsreactie tussen de analyt (de oplossing met de onbekende concentratie) en de zure of basistitrant is. Redox Titratie:
Een redox reactie omvat een oxidatie- en reductiereactie tussen de analyt en de titrant. Er is geen dergelijke regel dat het bestanddeel oxidiseert en welke een vermindert. Analyt of titrant oxidiseert, en het resterende bestanddeel vermindert dienovereenkomstig. Bepaling van het eindpunt:
Zure-base-titratie:
In het algemeen wordt een pH-indicator, een pH-meter of een geleidingsmeter gebruikt om het eindpunt van een zuurbasistitratie te bepalen. Redox Titratie:
De meest gebruikte methoden voor het bepalen van het eindpunt van een redoxreactie gebruiken een potentiometer of een redox-indicator. Maar meestal produceert de analyt of de titrant een kleur bij het eindpunt. Zo zijn er in deze gevallen geen extra indicatoren nodig. Voorbeelden:
Acid-Base Titration:
- diff Artikel Midden voor Tabel ->
Type| Reactie (Indicator) | Sterk zuur - Sterke basistitratie |
| HCl + NaOHàNaCl + H | 2 O (Fenolftaleïne / Methyl oranje) Sterk zuur - zwakke basistitratie |
| HCl + NH | 3 à NH 3 Cl (Methyloranje) Zwak zuur - sterke base titratie |
| CH | 3 COOH + NaOHà CH 3 COONa + H 2 O (fenolftaleïne) Zwak zuur-zwak base titratie |
| CH | 3 COOH + NH 3 - + NH 4 + Redox Titratie: 2 KMnO 4 |
+ 5 H
2 C 2 O 4 + 6 HCl → 2 MnCl 2 + 2KCl + 10 CO 2 + 8 H 2 O (+7) (+3) (+2) 4) In de bovenstaande reactie wordt permanganaat verminderd terwijl oxaalzuur geoxideerd wordt. Wanneer de reactie voltooid wordt, verandert de paars kleur van permanganaat in kleurloos. KMnO 4
+9FeCl
2
+ 8HCl → 5FeCl 3 + MnCl 2 + KCl + 4H 2 O (+7) (+2) (+3) (+2) Image Courtesy: 1. Titratie van zwak zuur met sterke basis Door Quantumkinetics (Eigen werk) [CC BY 3. 0], via Wikimedia Commons 2. "Winkler Titration Prior Titration" door Willwood [CC BY-SA 3. 0] via Commons




