Verschil tussen 1s en 2s orbital | 1s vs 2s Orbitaal
Sleutelverschil - 1s vs 2s Orbitaal
Atom is de kleinste eenheid van materie. Met andere woorden, alle materie is gemaakt van atomen. Een atoom bestaat uit subatomische deeltjes, voornamelijk protonen, elektronen en neutronen. Protonen en elektronen maken de kern, die zich in het midden van het atoom bevindt. Maar elektronen zijn gepositioneerd in orbitals (of energieniveaus) die zich buiten de kern van een atoom bevinden. Het is ook belangrijk om op te merken dat orbitalen hypothetische concepten zijn die gebruikt worden om de meest waarschijnlijke locatie van een atoom te verklaren. Er zijn verschillende orbitalen rond de kern. Er zijn ook sub-orbitals zoals s, p, d, f, enz. De s-orbitaal is sferisch in vorm als beschouwd als een 3D-structuur. De s orbital heeft de hoogste kans om een elektron rond de kern te vinden. Een sub-orbitaal wordt opnieuw genummerd als 1s, 2s, 3s, enz. Volgens de energieniveaus. Het belangrijkste verschil tussen 1s en 2s orbitaal is de energie van elke orbitaal. 1s orbitaal heeft een lagere energie dan de 2s orbitaal.
INHOUD
1. Overzicht en sleutelverschil
2. Wat is 1s Orbital
3. Wat is 2s Orbital
4. Zij aan elkaar Vergelijking - 1s vs 2s Orbitaal
5. Samenvatting
Wat is 1s Orbitaal?
1s orbitaal is de orbitaal die het dichtst bij de kern ligt. Het heeft de laagste energie onder andere orbitals. Het is ook de kleinste bolvormige vorm. Daarom is de straal van s orbitaal klein. Er kunnen slechts 2 elektronen in de s orbital zijn. De elektronconfiguratie kan als 1s 1 worden geschreven, als er slechts één elektron in de s-orbitale is. Maar als er een paar elektronen is, kan het worden geschreven als 1s 2 . Dan verplaatsen de twee elektronen in de s orbital naar de tegengestelde richtingen door de afstoting die optreedt door dezelfde elektrische ladingen van de twee elektronen. Wanneer er een ongepaarde elektron is, wordt het paramagnetisch genoemd. Dat komt omdat het door een magneet aangetrokken kan worden. Maar als de orbitaal gevuld is en een paar elektronen aanwezig zijn, kunnen de elektronen niet door een magneet worden aangetrokken; dit staat bekend als diamagnetisch.
Wat is 2s Orbitaal?
De 2s orbitaal is groter dan 1s orbitaal. Vandaar dat de straal groter is dan die van de 1s orbitaal. Het is de volgende kast orbitaal naar de kern na 1s orbitaal. Zijn energie is hoger dan 1s orbitaal, maar is lager dan andere orbitalen in een atoom. 2s orbitaal kan ook alleen worden gevuld met een of twee elektronen. Maar 2s orbitaal wordt alleen gevuld met elektronen na de voltooiing van 1s orbitaal.Dit heet Aufbau-principe, wat de volgorde van elektronevulling in sub-orbitals aangeeft.
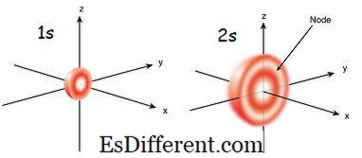
Figuur 01: 1s en 2s Orbitaal
Wat is het verschil tussen 1s en 2s Orbitaal?
- diff Artikel Midden voor Tabel ->
1s vs 2s Orbitaal |
|
| 1s orbitaal is de dichtstbijzijnde orbitaal naar de kern. | 2s orbitaal is de tweede dichtstbijzijnde orbitaal naar de kern. |
| Energieniveau | |
| Energie van 1s-orbitaal is hoger dan die van 2s-orbitaal. | 2s heeft relatief lager energie. |
| Radius van de baan | |
| De straal van 1s orbitaal is kleiner. | De straal van 2s orbitaal is relatief groot. |
| Orbitale grootte | |
| 1s orbitaal heeft de kleinste bolvormige vorm. | 2s orbitaal is groter dan de 1s orbitaal. |
| Electron Filling | |
| Elektronen worden eerst ingevuld in de 1s orbitaal. | 2s orbitaal wordt pas gevuld na voltooiing van elektronen in de 1s orbitaal. |
Samenvatting - 1s vs 2s Orbitaal
Een atoom is een 3D-structuur die een kern in het midden bevat, omringd door verschillende gevormde orbitalen van verschillende energieniveaus. Deze orbitalen worden opnieuw verdeeld in sub-orbitals volgens kleine verschillen in energie. Elektronen, die een belangrijk subatomisch deeltje van een atoom zijn, ligt in deze energieniveaus. 1s en 2s sub-orbitals zijn het dichtst bij de kern. Het belangrijkste verschil tussen 1s en 2s orbitals is het verschil van hun energieniveau, dat is 2s orbitaal een hoger energieniveau dan 1s orbitaal.
Referentie:
1. Libretexts. "Atoom-orbitalen. "Chemie LibreTexts. Libretexts, 03 nov. 2015. Web. 26 mei 2017..
2. Atomen, Elektronen en Orbitalen. N. p., n. d. Web. 26 mei 2017..
Image Courtesy:
1. "S orbitals" (gesneden) Door CK-12 Foundation - Bestand: High School Chemistry. pdf, pagina 265 (CC BY-SA 3. 0) via Commons Wikimedia



