Verschil tussen Thomson en Rutherford Model van Atom | Thomson vs Rutherford Model van Atom
Sleutelverschil - Thomson vs Rutherford Model van Atom
Het belangrijkste verschil tussen Thomson en Rutherford-model van atoom is dat Thomson-model van atoom geen details bevat over kern terwijl Rutherford-model van atoom verklaart over de kern van een atoom. J. J. Thomson was de eerste om het subatomische deeltje genaamd elektron in 1904 te ontdekken. Het model dat hij voorstelde, werd genoemd als 'pruimpuddingmodel van het atoom'. Maar in 1911 kwam Ernest Rutherford met een nieuw model voor het atoom na zijn ontdekking van de atoomkern in 1909.
INHOUD
1. Overzicht en sleutelverschil
2. Wat is Thomson Model of Atom
3. Wat is Rutherford Model of Atom
4. Side by Side Vergelijking - Thomson vs Rutherford Model van Atoom in Tabular Form
5. Samenvatting
Wat is Thomson Model of Atom?
Het Thomson model van atoom heet Plum pudding model omdat het zegt dat het atoom eruit ziet als een pruimpudding. De enige bekende details over het atoom in die tijd waren,
- Atomen zijn samengesteld uit elektronen
- Elektronen zijn negatief geladen deeltjes
- Atomen zijn neutraal geladen
Omdat elektronen negatief geladen zijn, stelde Thomson voor dat er een positieve lading moet zijn om neutraliseer de elektrische lading van het atoom. Het Thomson-model van atoom verklaart dat elektronen ingebed zijn in een positief geladen massief materiaal dat sferisch in vorm is. Deze structuur lijkt op een pudding met pruimen die daarop ingebed zijn en werd genoemd als pruimpuddingmodel van atoom. Dit bewees dat de aanname dat een atoom is neutrale geladen aangezien dit model zegt dat de negatieve ladingen van elektronen geneutraliseerd worden door de positieve lading van de vaste bol. Hoewel dit model bewijst dat atomen neutraal geladen zijn, werd het afgewezen na de ontdekking van de kern.

Figuur 01: Thomson Model van Atom
Wat is Rutherford Model of Atom?
Volgens het Rutherford-model van atoom was het zogenaamde Plum Pudding-model van Thomson onjuist. Rutherford-model van atoom wordt ook genoemd nucleair model omdat het details geeft over de kern van een atoom.
Het beroemde experiment genaamd "Rutherford gold foil experiment" leidde tot de ontdekking van de kern. In dit experiment werden alfa deeltjes gebombardeerd door een gouden folie; ze zouden naar verwachting rechtdoor gaan door de gouden folie. Maar in plaats van rechte penetratie veranderden alfa-deeltjes in verschillende richtingen.
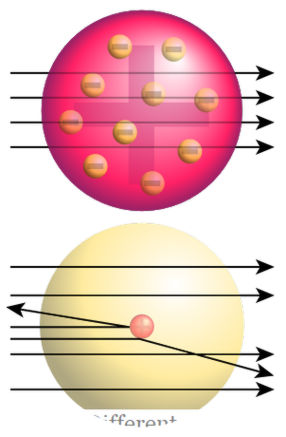
Figuur 2: Rutherford Gold Foil Experiment Top: Verwachte resultaten (Straight penetration) Bottom : Geobserveerde resultaten (Deflectie van sommige deeltjes)
Dit gaf aan dat er iets stevig is met een positieve lading in die gouden folie, die een botsing met alfa deeltjes veroorzaakt. Rutherford noemde deze positieve kern als de kern. Toen stelde hij het kernmodel voor het atoom voor; Het was samengesteld uit een positief geladen kern en negatief geladen elektronen die de kern omringen. Hij stelde ook voor dat elektronen in bepaalde afstanden in orbitals rond de kern liggen. Dit model heet ook planetair model omdat Rutherford suggereerde dat elektronen zich rondom de kern bevinden die vergelijkbaar zijn met de planeten die zich rondom de zon bevinden.
Volgens dit model is
- het atoom samengesteld uit een positief geladen centrum dat de kern wordt genoemd. Dit centrum bevatte de massa van het atoom.
- Elektronen bevinden zich buiten de kern in orbitalen op een aanzienlijke afstand.
- Het aantal elektronen is gelijk aan het aantal positieve ladingen (later protonen genoemd) in de kern.
- Het volume van de kern is verwaarloosbaar in vergelijking met het volume van het atoom. Vandaar dat de meeste ruimte in het atoom leeg is.
Dit Rutherford-model van atoom werd echter ook afgewezen omdat het niet kon verklaren waarom de elektronen en de positieve ladingen in de kern elkaar niet aantrekken.

Figuur 03: Rutherford Model van Atom
Wat is het verschil tussen Thomson en Rutherford Model van Atom?
Thomson vs Rutherford Model van Atom
Thomson model van atoom is het model dat verklaart dat elektronen ingebed zijn in een positief geladen massief materiaal dat sferisch in vorm is. |
|
| Rutherford model van atoom is het model dat verklaart dat er een kern in het midden van het atoom is en dat elektronen zich rondom de kern bevinden. | Nucleus |
| Thomson model van atoom geeft geen detail over de kern. | |
| Rutherford-model van atoom geeft details over de kern van een atoom en de plaats daarvan in het atoom. | Locatie van elektronen |
| Volgens Thomson-model van atoom zijn elektronen ingebed in een stevig materiaal. | |
| Rutherford model zegt dat elektronen zich rondom de kern bevinden. | Orbitals |
| Thomson model van atoom geeft geen details over orbitals. | |
| Rutherford-model van atoom legt uit over orbitals en dat elektronen zich in deze orbitalen bevinden. | Mass |
| Thomson-model van atoom verklaart dat de massa van een atoom de massa positief geladen is waar elektronen ingebed zijn. | |
| Volgens het Rutherford-model van atoom is de massa van een atoom geconcentreerd in de kern van het atoom. | Samenvatting - Thomson vs Rutherford Modellen van Atom |
Thomson en Rutherford modellen van atoom waren de vroegste modellen om de structuur van een atoom te verklaren. Na de ontdekking van het elektron door J. J. Thomson, stelde hij een model voor om de structuur van het atoom te verklaren. Later ontdekte Rutherford de kern en introduceerde een nieuw model met zowel elektronen als kernen. Het belangrijkste verschil tussen Thomson en Rutherford-model van atoom is dat Thomson-model van atoom geen details over kern bevat, terwijl Rutherford-model van atoom uitgelegd is over de kern van het atoom.
Download PDF Versie van Thomson vs Rutherford Modellen van Atom
U kunt de PDF-versie van dit artikel downloaden en deze gebruiken voor offline doeleinden zoals per aanhalingstekens. Download hier PDF-versie Verschil tussen Thomson en Rutherford Model van Atom.
Referentie:
1. Rutherford Model van de Atoom: Definitie en Diagram. "Studie. com. n. d. Web. Beschikbaar Hier. 06 juni 2017.
2. Brescia, Frank. Grondslagen van de chemie: een moderne inleiding (1966). Elsevier, 2012. Print.
3. Goldsby, Kenneth. Chemie. 12e ed. New York: McGraw-Hill, 2015. Print.
Image Courtesy:
1. "Pruimenpuddingatoom" (Openbaar domein) via Commons Wikimedia
2. "Rutherford-atoom" Door eigen werk (CreateJODER Xd Xd) (CC BY-SA 3. 0) via Commons Wikimedia
3. "Rutherford gold foil experiment results" Door gebruiker: Fastfission Eigen werk (Openbaar domein) via Commons Wikimedia




