Verschil tussen Sigma- en Pi-binding Verschil tussen
Wat is Sigma-binding?
Sigma-bindingen zijn bindingen tussen atomen in moleculen gevormd langs de as die de gebonden kernen van de atomen verbindt.
Moleculaire bindingen
Moleculen ontstaan wanneer atomen door chemische binding elektronen uitwisselen of delen. Er zijn in wezen drie soorten obligaties. Ionische bindingen, metalen bindingen en covalente bindingen. In ionische bindingen zullen de atomen eenvoudig een elektron uitwisselen zodat het ene atoom positief geladen wordt en het andere negatief geladen, waardoor ze aangetrokken worden door de elektromagnetische kracht. In metalen bindingen zullen elektronen uniform worden verdeeld door het gehele molecuul, waardoor een zee van vrije, gedelokaliseerde elektronen wordt gecreëerd die positief geladen ionen omvatten die worden aangetrokken door de elektronen.
In covalente bindingen worden elektronen gedeeld en de manier waarop ze worden gedeeld is door de waarschijnlijkheidswolken van de elektronen en de orbitalen waarin ze zich bevinden, overlappend op een manier die ruwweg symmetrisch is.
Orbitalen en sigmabindingen
Orbitalen zijn gebieden rond atomen die geassocieerd zijn met bepaalde energieniveaus. Elektronen in orbitalen verder van de kern zullen meer energie hebben dan elektronen in orbitalen dichter bij de kern. Wanneer de orbitalen van één atoom overlappen met de orbitalen van een ander atoom, vormen ze moleculaire orbitalen die moleculaire bindingen mogelijk maken die, natuurlijk, moleculen toestaan.
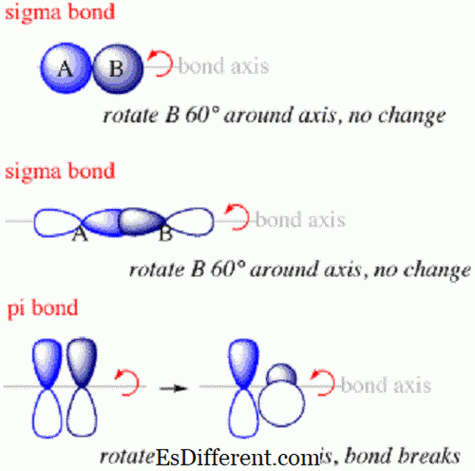
Sigma-bindingen zijn het eerste type binding dat zich tussen atomen zal vormen. Binnen een sigma-binding bevinden de elektronewaarschuwingswolken zich langs de as die de kernen van de gebonden atomen verbindt. Sigma-bindingen worden meestal gevormd wanneer s orbitalen van verschillende atomen elkaar overlappen om een binding te creëren. Ze zullen zich altijd langs de as tussen de twee kernen vormen omdat de s orbitaal is gerangschikt in zoiets als een bol rond de kern.
Sigma-bindingen en sigma-orbitalen
De elektronen die de sigma-binding vormen, bevinden zich binnen de sigma-orbitalen en bevinden zich dus ergens langs de as die de kernen van de gebonden atomen verbindt. De sigma-binding kan echter stabiel of onstabiel zijn, afhankelijk van het feit of de elektronen zich in een sigma-bindende orbitaal of een antiverbindende orbitaal bevinden.
Sigma-bindende orbitalen bevinden zich in de ruimte tussen de kernen, terwijl anti-bindende orbitalen zich langs de as bevinden die de kernen verbindt maar aan de zijkanten van de atomen tegenover de ruimte daartussen. De sigma-binding zal stabiel zijn als er meer elektronen in de verbindende orbitalen zitten en onstabiel zijn als er meer in de antibindende orbitalen zijn of als er een gelijk aantal elektronen in beide is.
Wat is Pi-binding?
Pi-bindingen zijn bindingen tussen atomen in moleculen waarbij de elektronen zich boven en onder de as bevinden die de kernen van de gekoppelde atomen verbindt, maar niet langs de as.Ze zijn het tweede type binding dat zich binnen een molecuul na de sigmaband zal vormen.
Pi-bindingen en p orbitalen
De reden dat pi-bindingen zich boven en onder de verbindingsas vormen, maar niet erlangs, is omdat ze zich meestal vormen vanuit overlappende orbitalen zoals p orbitalen op de gebonden atomen. Deze orbitalen hebben geen elektronendichtheid in de kern. Dientengevolge zullen de elektronen die de pi-bindingen vormen die vormen uit de overlappende p orbitalen zich altijd in een gebied clusteren dat niet direct grenst aan de kern. Pi-bindingen kunnen zich ook vormen tussen andere atoomorbitalen, zoals d orbitalen die dezelfde kenmerken hebben als p orbitalen.
Pi-bindingen en pi-orbitalen
Wanneer p orbitalen van verschillende atomen elkaar overlappen, creëren ze moleculaire pi-orbitalen waarmee pi-bindingen kunnen ontstaan. De binding kan opnieuw stabiel of onstabiel zijn, afhankelijk van de orbitaal waarin het elektron zich bevindt. De pi-binding is stabiel als er meer elektronen in de pi-bonding-orbitalen zitten. Het zal onstabiel zijn als er meer in de anti-bonding orbitals zitten of als een gelijk aantal in beide zijn.
Gelijkenissen tussen sigma-bindingen en pi-bindingen
Sigma-bindingen en pi-bindingen zijn beide gebaseerd op specifieke moleculaire orbitalen die zijn afgeleid van de overlapping van bepaalde atoomorbitalen, bijvoorbeeld s orbitalen in het geval van sigmabindingen en p orbitalen in het geval van pi-bindingen. Ze kunnen ook stabiel of instabiel zijn, afhankelijk van of er elektronen aanwezig zijn in de moleculaire orbitalen die de binding vormen of moleculaire orbitalen die de binding belemmeren.
Verschillen tussen sigma-obligaties en pi-obligaties
Ondanks hun overeenkomsten zijn er belangrijke verschillen.
- Elektronen die sigmabindingen vormen, zullen worden verdeeld in de ruimte langs de as die de gekoppelde kernen verbindt, terwijl elektronen binnen pi-bindingen boven en onder de as zullen worden verdeeld maar niet erlangs.
- Sigma-bindingen vormen de eerste bindingen tussen atomen in moleculen, terwijl pi-bindingen de tweede zijn.
- Sigma-bindingen worden vaak gevormd door de combinatie van s orbitalen in verschillende atomen, terwijl pi-bindingen worden gevormd uit de combinatie van p en soortgelijke orbitalen in verschillende atomen.
- Bovendien zal de richting van overlappende orbitalen die pi-bindingen vormen, loodrecht staan op die van overlappende orbitalen die sigmabindingen vormen.
Sigma-bindingen versus pi-bindingen
| Sigma-binding | Pi-binding |
| Atoomorbitalen overlappen langs verbindingsas | Atoomorbitalen overlappen boven en onder verbindingsas |
| Eerste bindingen vormen tussen moleculen binnen moleculen | Tweede verbindingen om te vormen tussen atomen in moleculen gevormd door overlappende orbitalen zoals |
| s orbitalen gevormd uit overlappende orbitalen zoals | p orbitalen overlappende orbitalen loodrecht op die van pi-bindingen |
| overlappende orbitalen loodrecht op die van sigma-bindingen | Samenvatting: Sigma en Pi-bindingen |
De sigma-binding is een binding tussen atomen binnen een molecuul die vaak wordt gevormd door
s < orbitalen overlappend langs de as die de gekoppelde kernen verbindt.Het is de eerste die zich vormt en de stabiliteit ervan hangt af van hoe de elektronen worden verdeeld in de sigma-bindende en antibewegende orbitalen. Pi-bindingen zijn moleculaire bindingen die vaak worden gevormd door overlappende p orbitalen van verschillende atomen. De elektronen die pi-bindingen vormen zullen worden verdeeld boven en onder de as die de kernen van de gebonden atomen verbindt, maar niet langs de as. De stabiliteit van deze bindingen hangt ook af van de bindings- en antiblegende pi-orbitalen. Sigma-bindingen zullen de eerste bindingen vormen binnen moleculen, terwijl pi-bindingen de tweede bindingen zullen vormen. Pi-bindingen vormen ook uit atomaire orbitalen die loodrecht op diegenen staan die sigmabindingen vormen.




