Verschil tussen S en P blokelementen | S versus P blokelementen
Belangrijkste verschil - S vs. P blokelementen
Het sleutelverschil tussen s en p blokelementen kan het best uitgelegd worden met behulp van hun elektronische configuratie. In de blokelementen van de s vult het laatste elektron in de subschil en in p blokelementen, vult het laatste elektron op de p subshell. Wanneer zij ionen vormen; s blokelementen verwijderen hun elektronen gemakkelijk uit de buitenste subshell, terwijl p blokelementen elektronen aannemen op de p subshell of elektronen verwijderen uit de p-subshell. Sommige elementen in de p-groep vormen positieve ionen die elektronen verwijderen uit de buitenste p-subshell en sommige elementen (de meeste elektronegatieve elementen) vormen negatieve ionen die elektronen van anderen accepteren. Als u de chemische eigenschappen beschouwt, is er een significant verschil tussen s en p blokelementen; dit komt hoofdzakelijk door de elektronconfiguratie.
Wat zijn S-blokelementen?
S-blokelementen zijn de chemische elementen in groep I en groep II in de periodieke tabel. Aangezien de subshell slechts twee elektronen kan bevatten, hebben deze elementen gewoonlijk één (groep I) of twee (groep II) elektronen in de buitenste schaal. De elementen in groep I en II worden hierboven in de tabel weergegeven.
- diff Artikel Midden voor tafel ->| IA | II A | |
| 2 | Li | Ben |
| 3 | Na | Mg |
| 4 | K | Ca |
| 5 | Rb | Sr |
| 6 | Cs | Ba |
| 7 | vr | Ra |
| IA | Alkali-metalen |
| II A | Alkalische aardmetalen |
Alle elementen in s-blok vormen positieve ionen en zijn zeer reactief.
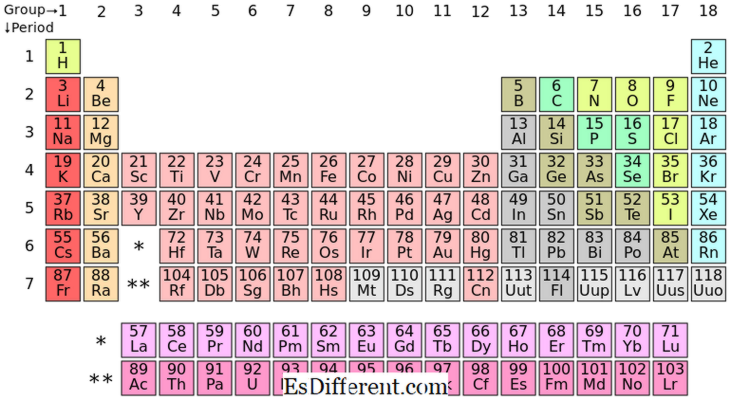
De plaatsing van de S-blokelementen in de periodieke tabel
Wat zijn P-blokelementen?
P-blokelementen zijn de elementen waarvan de laatste elektronen in p subshell invullen. Er zijn drie p-orbitalen; Elke orbitaal kan twee elektronen tegemoet komen, waardoor het totaal van zes p-elektronen wordt gemaakt. Daarom hebben p-blokelementen een tot zes p-elektronen in hun uiterste schaal. P-blok bevat zowel metalen als niet-metalen; Daarnaast zijn er ook metalloïden.
| 13 | 14 | 15 | 16 | 17 | 18 | |
| 2 | B | C | N | O | F Ne | 3 |
| Al | Si | P | S | Cl | Ar | 4 |
| Ga | Ge | Al | Se | Br | Kr | 5 |
| in | Sn | Sb | Te | I | Xe | 6 |
| Tl | Pb Bi | Po | Bij | Rn | Wat is het verschil tussen S en P blokelementen? | Common Electron Configuration: |
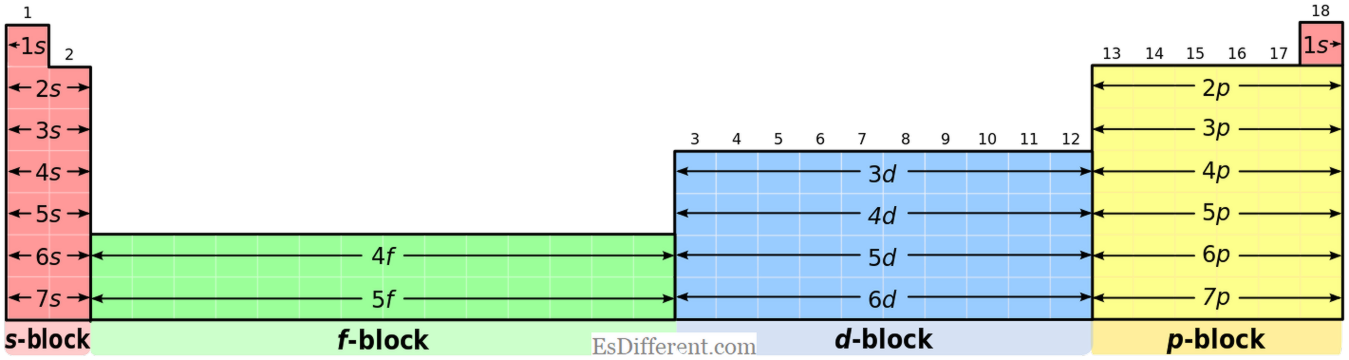
S-blokelementen:
S-blokelementen hebben de gemeenschappelijke elektronconfiguratie van [edelgas] ns
1 (voor groep I-elementen) en [edelgas] ns 2 (voor groep II elementen). P-blokelementen: P-blokelementen hebben de gemeenschappelijke elektronische configuratie van [edelgas] ns
2 np 1-6 . Maar helium heeft 1s 2 configuratie; het is een bijzondere situatie. Oxidatiestaten: S-blokelementen:
S-blokelementen tonen niet meerdere oxidatiestaten zoals p-blokelementen. Bijvoorbeeld, de groep I elementen tonen +1 oxidatie toestand en groep II elementen tonen +2 oxidatie staat.
P-blokelementen: In tegenstelling tot de s-blokelementen hebben p-blokelementen een gemeenschappelijke oxidatietoestand voor hun respectieve groep in de periodieke tabel en sommige andere additionele oxidatiestaten afhankelijk van de stabiliteit van het ion.
Groep 13
| 14 | 15 | 16 | 17 | 18 | Algemene elektronconfiguratie | ns |
| 2 | np 1 ns 2 | np 2 ns 2 | np 3 ns 2 | np 4 ns 2 np | 5 ns 2 np | 6 1 st lid van de groep |
| Wees < C N O | F | He | Gemeenschappelijke oxidatiegetal | +3 | +4 | +5 |
| -2 | -1 | 0 | Andere oxidatiestaten | +1 | +2, -4 | +3, -3 |
| +4, +2, | +3, +5, + 1, +7 | - | Eigenschappen: | S-blokelementen: | In het algemeen zijn alle s-blokelementen metalen. Ze zijn glanzend, goede elektrische en warmtegeleiders en gemakkelijk te verwijderen van elektronen van valence shell. Zij zijn de meest reactieve elementen in de periodieke tabel. | P-blokelementen: |
De meeste p-blokelementen zijn niet-metalen. Ze hebben lage kookpunten, slechte geleiders en het is moeilijk om elektronen uit de buitenste schaal te verwijderen. In plaats daarvan krijgen ze elektronen. Sommige van de niet-metalen zijn vaste stoffen (C, P, S, Se) bij kamertemperatuur, terwijl sommige gassen (zuurstof, stikstof) zijn. Bromine is een niet-metaal, en het is een vloeistof bij kamertemperatuur.
Bovendien bevat p-blok enkele metallische elementen; aluminium (Al), gallium (Ga), indium (In), tin (Sn), thallium (Tl), lood (Pb) en bismut (Bi). Image Courtesy:
1. "Periodieke tabel (polyatomische)" door DePiep [CC BY-SA 3. 0] via Commons 2. "Periodieke tabelblokken spdf (32 kolom)" door Gebruiker: DePiep [CC BY-SA 3. 0] via Commons



