Verschil tussen hydrolyse en condensatie Verschil tussen hydrolyse en condensatie
Hydrolyse vs Condensatie
Condensatie en hydrolyse zijn twee soorten chemische reacties, die betrokken zijn bij bindingvorming en bindingsbreuk. Condensatie is omgekeerd van hydrolyse. Deze twee soorten reacties worden vaak gevonden in biologische systemen, en we gebruiken deze reacties ook om veel commercieel belangrijke producten te verkrijgen.
Condensatie
Condensatie reacties zijn een soort chemische reactie waar kleine moleculen samenkomen om een groot enkel molecuul te vormen. De reactie vindt plaats binnen twee functionele groepen in de moleculen. Ander kenmerkend kenmerk van een condensatie reactie is dat een klein molecuul tijdens de reactie verloren gaat. Dit molecuul kan water, waterstofchloride, azijnzuur, enz. Zijn. Als het verloren molecuul water is, zijn deze typen condensatie reacties bekend als uitdrogingsreacties. Aangezien de reactiemolecules kleiner zijn en het productmolecuul zeer groot is, zal de dichtheid van de producten altijd hoger zijn dan de reacties bij condensatiereacties. Condensatie reacties vinden plaats op verschillende manieren. Zo kunnen we deze in grote groepen verdelen in twee typen als intermoleculaire condensatie reacties en intra-moleculaire condensatie reacties. Als de twee functionele groepen in hetzelfde molecuul wonen, staan ze bekend als intra-moleculaire condensaties. Bijvoorbeeld, glucose heeft een lineaire structuur als volgt.
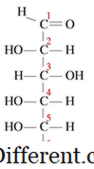
In een oplossing bevinden zich meerderheid van de moleculen in een cyclische structuur. Wanneer een cyclische structuur vormt, wordt de -OH op koolstof 5 omgezet in de etherbinding, om de ring met koolstof 1 te sluiten. Dit vormt een zes-ledige hemiacetale ringstructuur. Tijdens deze intra-moleculaire condensatie reactie wordt een watermolecule afgestoten en wordt er een etherverbinding gevormd. Intermoleculaire reacties produceren veel bruikbare en gemeenschappelijke producten. Hierbij vindt de reactie plaats tussen de functionele groepen van twee afzonderlijke moleculen. Bijvoorbeeld, bij het vormen van een macromolecule, zoals eiwit, worden aminozuren gecondenseerd. Een watermolecuul wordt vrijgegeven, en een amidebinding wordt gevormd die bekend staat als een peptidebinding. Wanneer twee aminozuren samen gebonden zijn, wordt een dipeptide gevormd, en als veel aminozuren worden aangesloten, wordt het een polypeptide genoemd. DNA en RNA zijn ook twee macromoleculen gevormd als gevolg van condensatie reacties tussen nucleotiden. Condensatie reacties produceren zeer grote moleculen en soms zijn de moleculen niet zo groot. Bijvoorbeeld: bij de veresteringsreactie tussen een alcohol en een carbonzuur, wordt een klein estermolecuul gevormd indien gevormd. Condensatie is belangrijk bij het vormen van polymeer. Polymeren zijn grote moleculen, die hetzelfde structurele eenheid herhalen, over en weer.De herhalende eenheden worden monomeren genoemd. Deze monomeren zijn aan elkaar gebonden met covalente bindingen om een polymeer te vormen.
Hydrolyse
Dit is een reactie waarbij een chemische binding gebroken wordt met behulp van een watermolecuul. Tijdens deze reactie splitst een watermolecule in een proton en een hydroxide-ion. En dan worden deze twee ionen toegevoegd aan de twee delen van het molecuul waar de band is gebroken. Bijvoorbeeld, volgt een ester. De esterbinding is tussen -CO en -O.

In de hydrolyse voegt het proton uit het water toe aan de -O kant, en het hydroxide-ion voegt aan de -CO-kant toe. Daarom zal als gevolg van de hydrolyse een alcohol en een carbonzuur vormen die de reactanten vormen bij het vormen van de ester.
|
Wat is het verschil tussen hydrolyse en condensatie? • Hydrolyse is omgekeerd van condensatie. • Condensatie reacties maken chemische bindingen terwijl hydrolyse chemische bindingen breekt. • Polymeren worden gemaakt door condensatie reacties, en ze worden door hydrolyse reacties gebroken. • Tijdens condensatiereacties kan watermolecule vrijgegeven worden. In de hydrolyse-reacties wordt watermolecuul in het molecuul opgenomen. |



