Verschil tussen combinatie- en ontbindingsreactie | Combinatie vs Decomposiereactie
Belangrijkste verschil - Combinatie versus decomposiereactie
Een chemische reactie is de omzetting van één of meer chemische verbindingen in een of meer verschillende producten, het veranderen van de identiteit van een chemische verbinding. Het uitgangsmateriaal van een chemische reactie wordt de reactant genoemd en de resulterende verbinding heet het product. Verdeling van verbindingen of combinatie van verbindingen en vorming van nieuwe verbindingen zal plaatsvinden tijdens een chemisch reactieproces, omdat de bindingen tussen atomen van de verbinding zijn gebroken en op een andere manier gecreëerd. Chemische reacties kunnen worden verdeeld in verschillende brede categorieën. Redox reacties of oxidatie-reductie reacties zijn zeer belangrijk onder hen. De oxidatie- en reductiereacties worden elektronoverdrachtsreacties genoemd, aangezien de elektronen van reactanten worden overgebracht van de ene verbinding naar het andere om de reactie te veroorzaken. Bij redoxreacties worden tegelijkertijd twee parallelle reacties, die halve reacties genoemd worden, opgetreden. Deze halve reacties tonen de overdracht van elektronen. Door deze halve reacties te evenwichten kan men de algehele reactie aan het eind raden. Combinatiereacties en ontledingsreacties zijn twee belangrijke soorten redoxreacties. Het belangrijkste verschil tussen de combinatie- en de ontledingsreactie is dat combinatiereactie een combinatie van reactanten omvat om een enkel product te geven, terwijl ontledingsreactie de verdeling van een enkele verbinding in twee of meer producten omvat.
INHOUD
1. Overzicht en sleutelverschil
2. Wat is een Combinatie Reactie
3. Wat is een ontbindingsreactie
4. Vergelijking naast elkaar - Combinatie tegen afbraakreactie
5. Samenvatting
Wat is een Combinatie Reactie?
Een combinatiereactie, ook wel synthese reactie genoemd, is een reactie waarbij reactante verbindingen gecombineerd worden om een andere verbinding als het product te vormen. Met andere woorden, de reactie van eenvoudige moleculen resulteert in een complex molecuul. Sommige of alle bindingen tussen atomen van die bepaalde verbinding zijn afgebroken; tegelijkertijd zullen atomen combineren om de nieuwe verbinding te vormen, dat is het product. Bij ontbindingsreacties werkt hetzelfde reagens als het uitgangsmateriaal voor beide halve reacties.In tegenstelling tot de ontledingsreacties hebben de halve reacties in combinatiereacties verschillende beginpunten. Combinatiereactie resulteert in een enkel product. Het volgende is een algemeen voorbeeld dat kan worden gegeven als verbrandingsreacties.
Als bijvoorbeeld aluminium (Al) in vloeibaar bromide (Br2 ) wordt geplaatst, vindt een combinatiereactie plaats en produceert aluminiumbromide (AlBr 3 ). Hier wordt het oxidatiegetal in Al verhoogd en verlaagd in Br. Daarom is het een redox reactie en is een combinatiereactie aangezien twee reactanten hebben gereageerd om een bepaald product te geven. Figuur 01: Combinatie Reactie
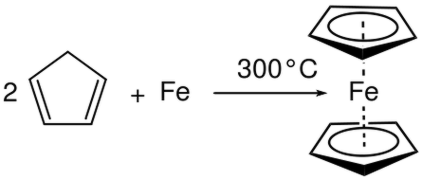
Ontledingsreactie is een andere belangrijke reactie in de categorie redoxreacties. Het is in principe het tegenovergestelde van de combinatiereactie. Een ontledingsreactie is een reactie waarbij reactiemiddelen in producten worden afgebroken. Hier vinden halveringstaken tegelijkertijd plaats als de oxidatie-reactie en de reductiereactie. Maar in tegenstelling tot de combinatiereactie is het reactant voor beide halve reacties hetzelfde bij ontbindingsreacties. Ontledingsreactie resulteert in verschillende producten.
Bij de elektrolyse van water, wanneer de gelijkstroom door water wordt doorgegeven, worden watermoleculen afgebroken om zuurstof- en waterstofgassen te geven. Hier wordt het oxidatiegetal in zuurstofatoom vermeerderd en in waterstofatoom verlaagd. Vandaar dat het een redoxreactie en een ontledingsreactie is door de afbraak van watermoleculen in zuurstof- en waterstofgassen.
Figuur 02: Combinatie vs Afbraak

Wat is het verschil tussen Combinatie- en Ontbindingsreactie?
- diff Artikel Midden vóór Tabel ->
Combinatie vs Decomposiereactie
Twee of meer reactantverbindingen zijn betrokken bij combinatiereacties. |
|
| Een enkele verbinding is betrokken bij een ontledingsreactie. | Producten |
| Combinatiereactie resulteert in een enkel product. | |
| Ontledingsreacties leiden tot verschillende producten. | Halfreacties |
| In combinatie reacties hebben twee halve reacties twee verschillende uitgangsmoleculen. | |
| Bij ontbindingsreacties functioneert een enkel molecuul als uitgangsmateriaal voor beide halve reacties. | Chemische bindingen |
| Combinatiereacties leiden tot binding van atomen om het enkel eindproduct te produceren. | |
| Bij ontbindingsreacties worden chemische bindingen afgebroken om twee of meer eindproducten te vormen. | Molecules |
| Combinatiereacties veroorzaken eenvoudige moleculen om te reageren en complexe moleculen te produceren. | |
| Ontledingsreacties veroorzaken complexe moleculen om in eenvoudige moleculen af te breken. | Samenvatting - Combinatie tegen ontledingsreactie |
Redoxreacties zijn zeer veel onderdeel van de wereld om ons heen omdat de meerderheid van de belangrijke chemische reacties redoxreacties zijn. Combinatiereacties en ontbindingsreacties zijn eenvoudige reacties die tegengesteld zijn van elkaar. Het belangrijkste verschil tussen combinatie- en ontledingsreactie is dat de combinatiereactie de combinatie van twee of meer reactiemoleculen omvat, resulterend in een enkel eindproduct, terwijl de ontledingsreactie de verdeling van een enkel molecuul in twee of meer producten omvat.
Referenties:
1. Chang, R., 2010. chemie. 10e ed. New York: McGraw-Hill.
2. Redox. (2009, 30 juli). Haalde 29 mei 2017, van // zwakinteracties. wordpress. com / primers / redox /
3. Reacties. (n. d.). Haalde 29 mei 2017, van // www. ric. edu / faculty / ptiskus / reacties /
Image Courtesy:
1. "Miller Ferrocen Synthese" Door Bert. Kilanowski - Eigen werk (CC0) via Commons Wikimedia
2. "Chemische reacties" Door Daniele Pugliesi - Eigen werk (CC BY-SA 3. 0) via Commons Wikimedia [Cropped]



