Verschil tussen Alpha Helix en Beta Plated Sheet | Alpha Helix and Beta Plated Sheet
Belangrijkste verschil - Alpha Helix vs Beta Plated Sheet
Alfa helices en beta-plated platen zijn de twee meest voorkomende secundaire structuren in een polypeptideketting. Deze twee structurele componenten zijn de eerste hoofdstappen in het proces van het vouwen van een polypeptideketen. Het sleutelverschil tussen Alpha Helix en Beta Plated Sheet is in hun structuur ; Ze hebben twee verschillende vormen om een specifieke baan te doen.
Wat is Alpha Helix?
Een alpha helix is een rechterhandige spoel aminozuurresten op een polypeptideketen. Het bereik van aminozuurresiduen kan variëren van 4 tot 40 resten. De waterstofbindingen gevormd tussen de zuurstof van C = O-groep op de bovenste spoel en de waterstof van de N-H-groep van de bodemspoel helpen de spoel samen te houden. Op de bovenstaande wijze wordt een waterstofbinding gevormd per elke vier aminozuurresten in de keten. Dit uniforme patroon geeft bepaalde eigenschappen zoals de dikte van de spoel en bepaalt de lengte van elke volledige draai langs de helix-as. De stabiliteit van de alfa-helixstructuur hangt af van verschillende factoren.

O atomen in rood, N atomen in blauw, en waterstofbindingen als groene stippellijnen
Wat is Beta Pleated Sheet?
Beta-platenblad, ook wel bekend als bètavel, wordt beschouwd als de tweede vorm van secundaire structuur in eiwitten. Het bevat bètastrengsels die lateraal verbonden zijn door een minimum van twee of drie ruggengraatwaterstofbindingen om een gedraaide, geplooide plaat te vormen zoals getoond in de afbeelding. Een beta-streng is een streep van de polypeptideketen; de lengte is over het algemeen gelijk aan 3 tot 10 aminozuren, inclusief ruggengraat in een uitgebreide bevestiging.
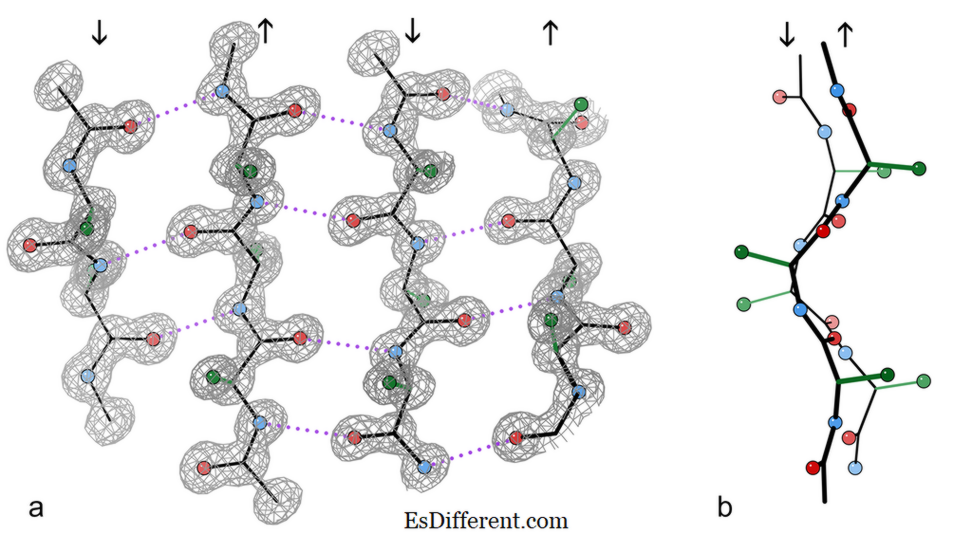
4-strengs antiparallel P-fragment uit een kristalstructuur van het enzym katalase.
a) het tonen van de antiparallelle waterstofbindingen (gestippeld) tussen peptide NH en CO groepen op aangrenzende strengen. Pijlen geven de kettingrichting aan en de contouren van de elektronen dichtheid geven de niet-H atomen aan. O atomen zijn rode ballen, N atomen zijn blauw, en H atomen zijn weggelaten voor eenvoud; zijkettingen worden alleen getoond aan het eerste zijwand C-atoom (groen)
b) Aanzicht van de centrale twee β-strengen
In betaplooide vellen lopen de polypeptideketens naast elkaar. Het wordt de naam "plated sheet" vanwege de golfachtige uitstraling van de structuur. Ze worden door elkaar verbonden door waterstofbindingen.Deze structuur maakt het mogelijk om meer waterstofbindingen te vormen door de polypeptideketen uit te strekken.
Wat is het verschil tussen Alpha Helix en Beta Plated Sheet?
Structuur van Alpha Helix en Beta Plated Sheet
Alpha Helix:
In deze structuur is de polypeptide backbone strak gebonden rond een denkbeeldige as als een spiraalstructuur. Het is ook bekend als de helicoïdale opstelling van de peptideketting.
De vorming van de alfa-helixstructuur gebeurt wanneer de polypeptideketens in een spiraal worden gedraaid. Dit stelt alle aminozuren in de keten in staat om waterstofbindingen (een binding tussen een zuurstofmolecuul en een waterstofmolecuul) met elkaar te vormen. Met de waterstofbindingen kan de helix de spiraalvorm vasthouden en een strakke spoel geven. Deze spiraalvorm maakt de alfa helix zeer sterk.
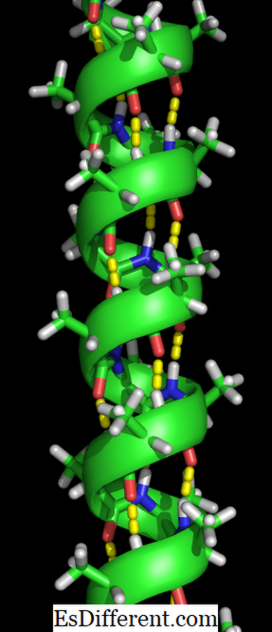
Waterstofbindingen worden aangeduid met de gele punten.
Beta Pleated Sheet:
Wanneer twee of meer fragmenten van polypeptide keten (en) elkaar overlappen, vormen een rij waterstofbindingen met elkaar, kunnen volgende structuren worden gevonden. Het kan op twee manieren gebeuren; parallelle opstelling en anti-parallelle regeling.
Voorbeelden van de structuur:
Alpha Helix: Vingernails of teennagels kunnen als voorbeeld van een alpha-helixstructuur worden gebruikt.
Beta Pleated Sheet: De structuur van veren is vergelijkbaar met de structuur van beta-platen.
Kenmerken van de structuur:
Alpha Helix: In de alfa-helixstructuur zijn er 3,6 aminozuren per draai van de helix. Alle peptidebanden zijn trans en planaire en de N-H groepen in de peptidebindingen wijzen in dezelfde richting, die ongeveer evenwijdig aan de as van de helix is. De C = O groepen van alle peptidebanden wijzen in de tegengestelde richting en zij zijn evenwijdig aan de as van de helix. De C = O groep van elke peptidebinding is gebonden aan de N-H groep van de peptidebinding die een waterstofbinding vormt. Alle R-groepen worden naar buiten uitgezonden van de helix.
Beta Pleated Sheet: Elke peptidebinding in het beta-platenblad is planauw en heeft de transconformatie. De C = O en N-H groepen peptidebindingen van aangrenzende ketens liggen in hetzelfde vlak en wijzen naar elkaar, waardoor waterstofbinding tussen hen wordt gevormd. Alle R-groepen in elke ketting kunnen alternatief voorkomen boven en onder het vlak van het vel.
Definities:
Secundaire structuur: Het is de vorm van een vouwproteïne door waterstofbinding tussen zijn ruggengraatamide en carbonylgroepen.
Referenties: "Proteïne Structuur". ChemWiki: De Dynamische Chemie Hypertext "Proteïne Secundaire Structuur: a-Helices en P-Sheets". Proteinstructures. com door Salam Al Karadaghi "Organische Chemie". Het virtuele cel handboek "Beta Sheet". Wikipedia Image Courtesy: "Helix electron density myoglobin 2nrl 17-32" Door Dcrjsr - Eigen werk (CC BY 3. 0) via Commons Wikimedia "Protein secundaire structuur" door: Gebruiker: Bikadi (CC BY-SA 3. 0) via Commons Wikimedia "1gwe antipar beta-blad beide" door Dcrjsr - Eigen werk (CC BY 3.0) via Commons Wikimedia

