Verschil tussen Alkanes en Alkene | Alkanen vs Alkene
Belangrijkste verschillen - Alkanen vs Alkenes
Alkanen en Alkenen zijn twee soorten koolwaterstoffamilies die koolstof en waterstof bevatten in hun moleculaire structuur. Het belangrijkste verschil tussen Alkanen en Alkenes is hun chemische structuur; alkanen zijn verzadigde koolwaterstoffen met de algemene moleculaire formule van C n H 2n + 2 en alkenen zijn een onverzadigde koolwaterstofgroep aangezien ze een dubbele binding bevatten tussen twee koolstof atomen. Zij hebben de algemene moleculaire formule van C n H 2n.
Wat zijn Alkanen?Alkanen bevatten alleen enkele bindingen tussen koolstof- en waterstofatomen (C-C bindingen en C-H bindingen). Daarom worden ze "verzadigde koolwaterstoffen" genoemd. Volgens het orbitale hybridisatiemodel hebben alle koolstofatomen in Alkenes de SP
3 hybridisatie. Ze vormen sigma-bindingen met waterstofatomen, en het resulterende molecuul heeft de geometrie van een tetraëder. Alkanen kunnen onderverdeeld worden in twee groepen volgens hun moleculaire regelingen; acyclische alkanen (C n H 2n. +2 ) en cyclische alkanen (C n H 2n ).

wordt de oude naam gebruikt om te verwijzen naar de alkeenfamilie. Het kleinste lid van deze familie is ethaan (C
2 H 4 ); Het heet olefisch t gas (in het Latijn: ' oleum' betekent 'olie' + 'facere' betekent 'te maken') in de vroege dagen. Dit komt doordat de reactie tussen C 2 H 4 en Chloor C 2 H 2 Cl 2 , olie.

n
H
2n + 2. Methaan (CH 4 ) is het kleinste alkaan. - diff Artikel Midden vóór tabel -> Naam Chemische formule Acyclische structuur Methaan
CH| 4 | CH 4 | Ethaan C |
| 2 | H 6 | CH 3 |
| CH | 3 Heftruck C 3 | H 8 CH 3 |
| CH | 2 CH 3 butaan | C 4 H 10 CH 3 CH |
| 2 | CH 2 CH 3 | Pentaan C 5 H 12 CH 3 CH |
| 2 | CH 2 CH 2 | CH 3 Hexaan C 6 H 14 CH 3 CH 2 |
| CH | 2 CH 2 CH | 2 CH 3 Heptaan C 7 H 16 CH 3 CH 2 |
| CH | 2 CH 2 CH 2 | CH 2 CH 3 Octane C 8 H 18 CH 3 CH 3 CH |
| 2 | CH 2 CH 2 | CH 2 CH 3 CH 3 Alkenen: Alkenen hebben de algemene chemische formule van C n H 2n .Alkenen worden beschouwd als onverzadigde koolwaterstoffen, aangezien zij niet het maximale aantal waterstofatomen bevatten die eigendom kunnen zijn van een koolwaterstofmolecuul. Naam Chemische formule Structuur Etheen C |
2 H 4 CH 2 = CH
| 2 | Propene | C |
| 3 | H 6 CH 3 CH = CH 2 | Buteen C 4 H |
| 3 | CH 2 = CHCH 2 CH 3, | CH 3 CH = CHCH 3 penteen C |
| 5 | H 10 CH 2 = | CHCH 2 CH 2 CH 3, CH 3 CH = CHCH 2 |
| CH 3 | Hexeen C 6 H 12 | CH 2 = CHCH 2 CH 2 CH 2 CH 3 CH 3 CH = CHCH 2 |
| CH | 2 CH 3 CH | 3 CH 2 CH = CHCH 2 CH 3 hepteen C 7 H 14 CH = CHCH < 2 CH
2 CH 2 CH 2 CH 3 CH 3 CH = CH < 2 |
| CH | 2 CH 2 CH | 3 Chemische eigenschappen van alkanen en alkanen Alkanen: Reactiviteit: Alkanen zijn inert tegen veel chemische reagentia. Dit komt doordat koolstof-koolstof (C-C) en koolstof-waterstof (C-H) bindingen vrij sterk zijn, omdat koolstof- en waterstofatomen bijna dezelfde elektronegativiteitswaarden hebben. Daarom is het zeer moeilijk om hun bindingen te breken, tenzij ze worden verwarmd tot vrij hoge temperaturen. Verbranding: Alkanen kunnen gemakkelijk in de lucht verbranden. De reactie tussen alkanen met overmatig zuurstof heet "verbranding". In deze reactie worden alkanen omgezet naar kooldioxide (CO 2 ) en water. C n H 2n + (n + n / 2) O 2 → n CO 2 + nH 2 O C 4 H 10 |
+ 13/2 O
2 → 4 CO
2
+ 5H 2
O
Butaan Zuurstof Koolstofdioxide Water De verbrandingsreacties zijn exotherme reacties (ze geven warmte af). Als gevolg hiervan worden alkanen gebruikt als bron van energie. Alkenen:
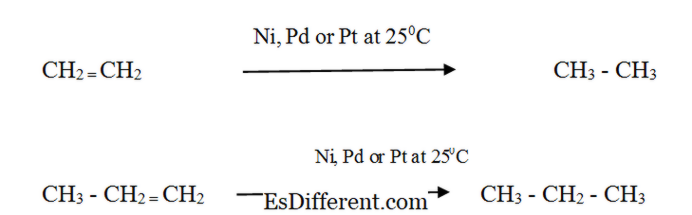
Reactiviteit: Alkenen reageren met waterstof in aanwezigheid van een fijnverdeelde metalen katalysator om het overeenkomstige alkaan te vormen. De snelheid van de reactie is zeer laag zonder een katalysator. Katalytische hydrogenering wordt in de voedingsindustrie gebruikt om vloeibare plantaardige oliën te omzetten in semi-vast vet bij het maken van margarine en vaste kookvet. Fysische eigenschappen van alkanen en alkanen Vormen Alkanen: Alkanen bestaan als gassen, vloeistoffen en vaste stoffen. Methaan, ethaan, propaan en butaan zijn gassen bij kamertemperatuur. De onbewerkte structuren van hexaan, pentaan en heptaan zijn vloeistoffen. Alkanen met een hoger molecuulgewicht zijn vaste stoffen. CH 4 tot C 4
H 10 zijn gassen C 5 H 12 naar C 17 H 36
zijn vloeistoffen en
Alkanen met een hoger molecuulgewicht zijn zachte vaste stoffen
Alkenen:
Alkenen tonen vergelijkbare fysische eigenschappen van de overeenkomstige Alkaan. Alkenen met lagere molecuulgewichten (C
2
H
4
tot C
4 H
8 ) zijn gassen bij kamertemperatuur en atmosferische druk.Alkenen met een hoger molecuulgewicht zijn vaste stoffen. Oplosbaarheid: Alkanen: Alkanen oplossen niet in water. Ze worden opgelost in niet-polaire of zwak polaire organische oplosmiddelen. Alkenen: Alkenen zijn relatief polaire moleculen door de C = C binding; daarom zijn ze oplosbaar in niet-polaire oplosmiddelen of oplosmiddelen met lage polariteit. Water is een polaire molecuul en alkenen zijn licht oplosbaar in water.
Dichtheid: Alkanen: De dichtheden van Alkanen zijn lager dan de dichtheid van water. Hun dichtheidswaarde is bijna 0,7 g ml -1 , gezien de dichtheid van water als 1. 0 g ml -1 . Alkenes: De dichtheden van Alkenen zijn lager dan de dichtheid van water.
Kookpunten:
Alkanen: Het kookpunt van onvertakte alkanen stijgt vlot als het aantal koolstofatomen en het molecuulgewicht toenemen. In het algemeen hebben vertakte alkanen lagere kookpunten vergeleken met de onvertakte alkanen, met hetzelfde aantal koolstofatomen. Alkenes : Kookpunten zijn vergelijkbaar met de overeenkomstige alkanen met een kleine variatie. Referenties: CliffsNotes. (n. d.). Getrokken 06 juli 2016, vanaf hier. Fysische eigenschappen van alkanen. (2013). Haalde 06 juli 2016, vanaf hier Zum Directory-modus. (n. d.). Getrokken 06 juli 2016, vanaf hier Chemische eigenschappen van de Alkanen: Wizznotes. com- Free GCSE en CXC: Tutorials, Past Papers en Quizzes. (n. d.). Haalde 06 juli 2016, vanaf hier Polariteit. (n. d.). Gekregen 06 juli 2016, vanaf hier
Dipole momenten. (2013). Getrokken 06 juli 2016, vanaf hier
Structuraal isomeer. (n. d.). Haalde 06 juli 2016, vanaf hier Een inleiding tot alkenen. (n. d.). Hernieuwd 06 juli 2016, vanaf hier
Image Courtesy: "Alkenen namen" Door Chris Evans - (CC0) via Commons Wikimedia
"Met koolzuurhoudende C4 koolwaterstoffen" Door Fvasconcellos - Eigen werk Public Domain) via Commons Wikimedia




