Verschil tussen fenyl en benzyl | Phenyl versus benzyl
fenyl vs benzyl
Zowel fenyl als benzyl zijn afgeleid van benzeen, en worden vaak verward door studenten van de chemie. Fenyl is een koolwaterstofmolecuul met de formule C 6 H 5 , terwijl benzyl C 6 H 5 CH 2 <; een extra CH 2 groep verbonden aan de benzeenring. Phenyl
Fenyl is een koolwaterstofmolecuul met de formule C

H 5 . Dit is afgeleid van benzeen, dus heeft vergelijkbare eigenschappen als benzeen. Dit verschilt echter van benzeen door het ontbreken van een waterstofatoom in één koolstof. Dus het molecuulgewicht van fenyl is 77 g mol -1 . Fenyl wordt afgekort als Ph. Gewoonlijk is fenyl verbonden met een andere fenylgroep, atoom of molecuul (dit deel staat bekend als de substituent, R-groep zoals in de figuur). De koolstofatomen van fenyl zijn sp2 gehybridiseerd zoals in benzeen. Al de koolstoffen kunnen drie sigma bindingen vormen. Twee van de sigma-bindingen worden gevormd met twee aangrenzende koolstofatomen, zodat het een ringstructuur tot gevolg zal hebben. De andere sigma-binding wordt gevormd met een waterstofatoom. In een koolstof, in de ring, wordt de derde sigma binding echter gevormd met een ander atoom of molecuul dan een waterstofatoom. De elektronen in p-orbitalen overlappen elkaar om de gedelocaliseerde elektronenwolk te vormen. Daarom heeft fenyl gelijkaardige C-C bindingslengten tussen alle koolstoffen, ongeacht afwisselende enkelvoudige en dubbele bindingen. Deze C-C bandlengte is ongeveer 1. 4 Å. De ring is vlak en heeft een 120 ° hoek tussen bindingen rond een koolstof. Door de substituentgroep van fenyl veranderen de polariteit en andere chemische of fysische eigenschappen. Als de substituent elektronen schenkt aan de gedeokaliseerde elektronwolk van de ring, staan deze bekend als elektronendonerende groepen (E.g.-OCH 3 , NH 2 ). Als de substituent elektronen van de elektronenwolk trekt, staat het bekend als elektronen-terugtrekkende substituent. (E.g.-NO 2 , -COOH). Fenylgroepen zijn stabiel vanwege hun aromatiteit, zodat ze niet gemakkelijk oxidaties of reducties ondergaan. Verder zijn ze hydrofoob en niet-polair. Benzyl De formule van benzyl is C
6H
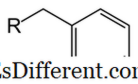
5 CH 2 . Dit is ook een afgeleide van benzeen. In vergelijking met fenyl heeft benzyl een CH 2 groep die aan de benzeenring is bevestigd. Een ander molecuuldeel (R-groep zoals afgebeeld in de foto) kan aan de benzylgroep worden gehecht via binding aan het CH 2 koolstofatoom. Benzylgroep wordt afgekort als "Bn". Het molecuulgewicht van de benzylgroep is 91 g mol -1 . Aangezien er een benzeenring is, is de benzylgroep aromatisch.In organische chemiemechanismen kan de benzylgroep gevormd worden als een radicale carbocatie (C 6 H 5 CH 2 + ) of een carboanion (C 6 H 5 CH 2 - ). Bij bijvoorbeeld nucleofiele substitutiereacties wordt bijvoorbeeld benzylzuur- of kationmengsel gevormd. Er is een hogere stabilisatie van deze tussenproducten vergeleken met het alkylradicaal of kation. De reactiviteit van de benzylpositie is vergelijkbaar met die van de allylische positie. Benzylgroepen worden vaak in organische chemie gebruikt als beschermende groepen, met name om carboxylzuur- of alcoholfunctionele groepen te beschermen.
5
CH < 2 . • Benzyl heeft extra CH 2 groep in vergelijking met fenyl. • In fenyl is de benzeenring direct verbonden aan een substituentmolecuul of een atoom, maar in benzyl maakt de CH 2 de verbinding met een ander molecuul of een atoom.




