Verschil tussen pyruvaat en pyruvinezuur | Pyruvate vs Pyruvic Acid
Belangrijkste verschil - Pyruvaat versus Pyruvinezuur
De termen Pyruvaat en Pyruvinezuur worden vaak gebruikt omruilbaar; echter, is er een duidelijk verschil tussen hen:
Pyruvinezuur is een zuur , wat aangeeft dat het een waterstofion vrijlaat en bindt met een positief geladen natrium of kalium ion om een zuurzout vormen, ook wel bekend als pyruvaat. Met andere woorden, pyruvaat is een zout of ester van pyruvinezuur. Dit is het sleutelverschil tussen pyruvaat en pyruvinezuur en beide stoffen worden gebruikt in biologische en metabolische wegen, maar zijn nauw verbonden.
Wat is pyruvinezuur?Pyruvinezuur speelt een belangrijke rol in de menselijke stofwisseling. Bijvoorbeeld wordt energie aan levende cellen geleverd door cellulaire aërobe ademhaling of pyruvinezuur wordt gefermenteerd om melkzuur door fermentatie te produceren. Pyruvinezuur is een vloeistof van aard, en is kleurloos en heeft een geur die gelijk is aan azijnzuur. Het is een zwak zuur, en het wordt opgelost in water. De chemische formule van pyruvinezuur is (CH 3
COCOOH) en wordt beschouwd als de eenvoudigste vorm van de alfa-ketozuren met een carboxylzuur en een ketonfunctionele groep. Daarnaast is pyruvinezuur een carbonzuur dat niet zo sterk is als anorganische zuren zoals zoutzuur.

-
. Met andere woorden, pyruvaat is de anion die wordt geproduceerd uit pyruvinezuur. Het belangrijkste verschil tussen pyruvinezuur en pyruvaat is dat het waterstofatoom op de carbonzuurgroep is gedisassocieerd, of het is verwijderd. Dit verschaft een negatief geladen carboxylaatgroep aan het pyruvaat. Door de zwakke zure aard van pyruvinezuur dissocieert het zich gemakkelijk in water en vormt daardoor pyruvaat. Pyruvaat is een belangrijke chemische verbinding in humane metabolisme en biochemie. Pyruvate is betrokken bij het metabolisme van glucose en staat ook bekend als glycolyse. In het glycolyseproces wordt één molecuul glucose afgebroken in twee pyruvatenmoleculen, die vervolgens worden gebruikt in verdere reacties op het produceren van energie.
Definitie van
Pyruvaat en Pyruvinezuur
Pyruvinezuur: Pyruvinezuur is een
Geelachtige kleur Organisch zuur . Pyruvaat: Pyruvaat is een zout of ester van pyruvinezuur.
Kenmerken van Pyruvaat en Pyruvinezuur
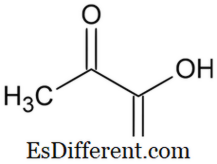
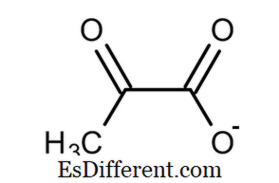
Chemische Formule en Moleculaire Structuur Pyruvinezuur
: CH
3 COCOOH Pyruvaat : CH3COCOO
- Proton en Electron Balance Pyruvinezuur:
Pyruvinezuur heeft het
zelfde aantal elektronen als protonen . Pyruvate: Pyruvate heeft
meer elektronen dan protonen . Synthese Pyruvinezuur:
Pyruvinezuur kan gesynthetiseerd worden uit melkzuur.
Pyruvaat: Pyruvaat is het anion gesynthetiseerd uit pyruvinezuur. Wanneer pyruvinezuur in water is opgelost, neigt het om een pyruvaat ion en een proton te dissociëren en te synthetiseren.
Zuren Pyruvinezuur:
Pyruvinezuur is een zwak organisch zuur.
Pyruvaat: Pyruvaat is de geconjugeerde basis van pyruvinezuur.
Carboxylische functionele groep Pyruvinezuur:
Pyruvinezuur heeft een carboxylzuur (COOH) functionele groep.
Pyruvaat: Pyruvaat heet een carbonaat anion die COO
bevat -. Charge Pyruvinezuur:
Pyruvinezuur heeft een
Neutrale lading . Pyruvate: Pyruvate heeft een
negatieve lading . Vermogen om een Proton te geven Pyruvinezuur:
Pyruvinezuur heeft het vermogen om een proton op te geven.
Pyruvate: Pyruvate kan een proton niet opgeven.
Dominante Vorm Pyruvinezuur:
Pyruvinezuur is de
minder dominante -vorm in een celomgeving in vergelijking met pyruvaat. Pyruvate: Pyruvate is het
meer dominant formulier in een celomgeving in vergelijking met pyruvinezuur. Intramoleculaire Waterstofbinding
Pyruvinezuur: Pyruvinezuur heeft een intramoleculaire waterstofbinding.
Pyruvate: Pyruvate heeft geen intra-moleculaire waterstofbinding.
Referenties: Cody, G.D., Boctor, N.Z., Filley, T.R., Hazen, R.M., Scott, J.H., Sharma, A. en Yoder, H. S. (2000). Primordiale koolwaterhoudende ijzer-zwavelverbindingen en de synthese van pyruvaat. Wetenschap,
289
(5483): 1337-1340. Image Courtesy: "Pyruvic-acid-3D-ballen". (Public Domain) via Wikimedia Commons.




