Verschil tussen Nitraat en Nitriet
Nitraat versus Nitriet
Zowel nitraat als nitriet zijn oxyanionen van stikstof. Hoewel ze beide lijken te lijken, zijn er verschillen tussen hen. Deze verschillen kunnen zijn met betrekking tot hun structuur, binding, geometrische vorm, oxidatietoestand van stikstof, chemische reactiviteit, toepassingen van hen en dergelijke. Deze verschillen worden hier vooral besproken.
NO 3 - ionen is de geconjugeerde basis van HNO 3 (salpeter V zuur), dat een sterk zuur is. Het is een platte molecuul met sp 3 hybridisatie in stikstofatoom. Al drie zuurstofatomen zijn gelijkwaardig. Er zijn 24 elektronen in de valence shells. NEE 3 - ionen heeft het molecuulgewicht van 62. 004 g mol -1 .
NO 2 - ionen is de geconjugeerde basis van HNO 2 (salpeterzuur III), dat een zwak zuur is (pKa = 3, 5). Het is ook een platte molecuul met sp 2 hybridisatie. In de valenschelpen zijn er maar 18 elektronen. NEE 2 - ionen heeft het molecuulgewicht van 46. 006 g mol -1 .
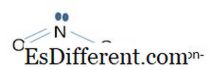

Wanneer de binding in beide ionen wordt beschouwd, in NO 3 - ion, omvat de pi binding vier 2p z atoom orbitalen (één orbitla van N en drie orbitalen van 3 zuurstofatomen). Deze vier atomaire orbitalen vormen 4, vier-centrische pi moleculaire orbitalen. De moleculaire orbitaal met de laagste energie is de bindingsbaan. De orbitaal met de grootste energie is de anti-bindende orbitaal. Andere twee orbitalen zijn gedegenereerd (gelijk aan energie) die niet-bindende orbitalen zijn. In het geval van NO 2 - ion, omvat de pi binding slechts drie 2p z atoom orbitalen. Hier is de orbitaal met de laagste energie de bindingsbaan, de middelste is de non-bonding orbitaal, en de andere is de anti-bindende orbitaal. In beide ionen behoren de bindingsorbitals tot het maken van π-bindingen (sigma-binding) en niet-bindende orbitalen bij het maken van π-bindingen (pi-bindingen). Daarom heeft elke band in NO 3 - ion een bandorde van 1 1 / 3 . 1 uit σ-bond en 1 / 3 van de π-obligaties. In NO 2 - ion is de bindingsvolgorde 1 1 / 2 . 1 uit σ-bond en 1 / 2 van de π-obligaties.
Hoewel beide ionen uit dezelfde elektronische geometrie bestaan, omdat de bindingsorder anders is, zijn hun geometrische vormen ook verschillend. De NO 3 - ionen heeft een vorm van platte driehoekige en de NO 2 - ionen heeft een hoekvorm (of V vorm). De bandhoeken zijn ook verschillend. ONO verbindingshoek van NO 3 - ionen en NO 2 - ionen zijn respectievelijk 120 0 en 115 0 . De oxidatie toestand van stikstof in zowel NO 3 - ion en NO 2 - ionen zijn respectievelijk +5 en +3.Vanwege deze redenen (vooral het verschil in binding) bestaat de chemische reactiviteit (zoals de basiciteit, het oxiderende / reducerende vermogen, de producten van thermische ontleding van de verbindingen uit deze ionen) ook verschillend.
In de praktijk is NO 2 - ion een zwakkere basis, terwijl NO 3 - ion een zeer zwakkere basis is. Wanneer de oxydatietoestand van stikstofatoom in deze ionen in overweging wordt genomen, kan NO 2 - ionen fungeren als een reductiemiddel evenals een oxidatiemiddel, terwijl NO 3 - ionen kan alleen fungeren als oxidatiemiddel.

De voorbeelden voor producten verkregen door thermische ontleding van NO 3 - en NO 2 - ionen bevattende verbindingen worden hieronder gegeven om het verschil in reactiviteit te tonen.

Zelfs wanneer ze complexen vormen met metaalionen, gedragen ze op een andere manier. Dat wil zeggen dat geen 2 - ion optreedt als een monodentaatligand, terwijl NO 3 - ion optreedt als een bidentaatligand.
Deze verschillen in chemische reactiviteit helpen ons om het gebruik ervan te differentiëren. Bijvoorbeeld worden nitritten meestal gebruikt bij de verwerking van vlees (soms worden ook nitraten gebruikt) en nitraten worden gebruikt voor het produceren van explosieven. Nitraten zijn van nature voorkomend en zijn kankerachtig. Maar Nitriten zijn niet kankerachtig.