Verschil tussen Hydroxyl en Hydroxide | Hydroxyl vs Hydroxide
Belangrijkste verschil - Hydroxyl vs Hydroxide
De twee termen hydroxyl en hydroxide klinken zeer vergelijkbaar, aangezien beide van hen twee gelijkaardige atomen, zuurstof (O = 16) en waterstof (H = 1). Hydroxide is een negatief ion met een enkele lading en hydroxyl wordt niet gevonden in zijn vrije vorm, het is een onderdeel van een ander molecuul of ion. Hydroxide ionen zijn meer reactief dan de hydroxylgroep in een molecuul. Dit is het belangrijkste verschil tussen hydroxyl en hydroxide.
Wat is Hydroxyl?
Hydroxyl is een neutrale verbinding en het is de overeenkomstige elektrisch neutrale verbinding van hydroxide ion. De vrije vorm van hydroxyl (• HO) is een radical en wanneer het covalent gebonden is aan andere moleculen wordt het aangeduid als de hydroxylgroep (-OH). Hydroxylgroepen kunnen fungeren als nucleofielen en hydroxylradicaal wordt gebruikt als katalysator in organische chemie. Hydroxylgroepen zijn niet sterk reactief als de andere nucleofielen. Zij zijn echter de facilitators in de vorming van sterke intramoleculaire krachten genaamd 'waterstofbindingen'.

Wat is Hydroxide?
Hydroxide is een diatomische anion die een zuurstofatoom en een waterstofatoom bevat. De binding tussen zuurstof en waterstofatoom is covalent en de chemische formule ervan is OH - . Zelfionisatie van water produceert hydroxylionen en daarom zijn hydroxylionen een natuurlijk onderdeel in het water. Hydroxide ionen worden gebruikt als basis, een ligand, een nucleofiel en een katalysator in chemische reacties. Bovendien produceren waterstofionen zouten met metaalkationen en de meeste daarvan dissociëren in waterige oplossingen, waardoor gesolvateerde hydroxide-ionen vrijkomen. Veel anorganische chemische stoffen bevatten de term "hydroxide" in hun naam, maar ze zijn niet ionisch en zij zijn covalente verbindingen die hydroxylgroepen bevatten.

Wat is het verschil tussen Hydroxyl en Hydroxide?
Structuur:
Hydroxyl: Hydroxyl is een elektrisch neutrale verbinding die op twee manieren kan worden gevonden, zoals de radicale en de covalent gebonden vorm.

Hydroxylradicaal Wanneer het covalent gebonden is aan een molecuul
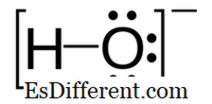
Hydroxide: Hydroxide is een negatief geladen ion en de negatieve lading ligt op het zuurstofatoom.
Hydroxyl: Hydroxylgroepen worden gevonden in veel organische verbindingen; alcoholen, carbonzuren en hydroxylgroepen die suiker bevatten. Verbindingen die hydroxylgroepen bevatten, zoals water, alcoholen en carbonzuren, kunnen gemakkelijk gedeprotoneerd worden.Bovendien zijn deze hydroxylgroepen betrokken bij de vorming van waterstofbindingen. Waterstofverbindingen helpen de moleculen bij elkaar te houden en dit leidt tot het bezit van hogere kook- en smeltpunten. In het algemeen zijn organische verbindingen slecht wateroplosbaar; deze moleculen worden licht wateroplosbaar wanneer zij twee of meer hydroxylgroepen bevatten.
Hydroxide: De meeste chemicaliën die hydroxide bevatten, worden beschouwd als zeer corrosief, en sommige zijn zeer schadelijk. Wanneer deze chemicaliën in water worden opgelost, fungeert het hydroxide-ion als een ongelooflijk sterke basis. Aangezien hydroxide ion een negatieve lading draagt, wordt het vaak gebonden aan positief geladen ionen.
Sommige ionische verbindingen die hydroxidegroepen bevatten in hun molecuul oplossen heel goed in water; corrosieve basen zoals natriumhydroxide (NaOH) en kaliumhydroxide (KOH) kunnen als voorbeeld worden gebruikt. Echter, sommige andere hydroxide bevattende ionische verbindingen zijn licht onoplosbaar in water; Voorbeelden zijn koper (II) hydroxide [Cu (OH) 2 - helderblauw) en ijzer (II) hydroxide [Fe (OH) 2 - bruin].
Reactiviteit:
Hydroxyl : Hydroxylgroepen zijn minder reactief in vergelijking met de hydroxide groep. Maar hydroxylgroepen vormen gemakkelijk waterstofbindingen en dragen bij tot het maken van molecules die meer oplosbaar zijn in water.
Hydroxyl radicalen zijn echter zeer reactief en zeer nuttig bij organische chemische reacties.
Hydroxide: Hydroxide (OH - ) groep wordt beschouwd als een sterke nucleofiele in Organische chemie.
Referenties: Martin. chaplin @ btinternet. com, M.C. (n. d.). Hydroxide ionen. Haalde 28 december 2016, van hierHydroxide Ion: Definitie & Formule - Video & Les Transcript. (n. d.). Gehaald 28 december 2016, van hierHydroxide. (n. d.). Getrokken 28 december 2016, van hier Hydroxy groep. (n. d.). Haalde 28 december 2016, van hierHydroxylgroep: Definitie, Structuur & Formule. (n. d.). Haalde 28 december 2016, van hieruit H. (2014). Wat is een hydroxylgroep? Haalde 28 december 2016, vanaf hier

