Verschil tussen ethanol en ethaanzuur | Ethanol vs Ethanoic Acid
Belangrijkste verschil - Ethanol vs Ethanoic Acid
Hoewel Ethanol en Ethanoic Acid soortgelijke namen hebben, kan een belangrijk verschil tussen hen worden gezien, omdat ze twee verschillende organische verbindingen bevatten die twee verschillende functionele groepen bevatten. Ethanol is het tweede eenvoudigste lid van de alcoholfamilie terwijl ethaanzuur het tweede eenvoudigste lid van de carbonzuurgroep is. Beide bevatten alleen maar twee koolstofatomen naast de functionele groep aanwezig in het molecuul. Wanneer we hun chemische eigenschappen vergelijken beide worden gebruikt als organische oplosmiddelen en bezitten een karakteristieke geur. Daarentegen is ethaanzuur zuurder dan ethanol.
Wat bedraagt Ethanol ?
De gemeenschappelijke naam van ethanol is ethylalcohol . De functionele groep is een hydroxylgroep (-OH groep). Alle chemische eigenschappen zoals reactiviteit, zuurheid of basiciteit zijn afhankelijk van de functionele groep. Ethanol heeft een zeer milde geur, en het is een vluchtige verbinding. Ethanol is zeer belangrijk in haar industriële toepassingen; Het is een veilig oplosmiddel, een brandstofbron, gebruikt om geneesmiddelen en cosmetica te produceren en het is het belangrijkste bestanddeel in alcoholische dranken. Ethanol kan binnenlands worden geproduceerd met behulp van agrarisch afval zoals maïs, suikerriet of grassen.

Wat is ethanoic acid ?
De meest gebruikte naam voor ethaanzuur is azijnzuur . Het is een kleurloze vloeistof met een karakteristieke zure smaak en scherpe geur. Het heeft de moleculaire formule van CH 3 COOH. De onverdunde vorm van het ethaanzuur heet "ijsazijnzuur" en ongeveer 3-9% zuurvolume wordt gebruikt om azijn te maken. Ethaanzuur wordt beschouwd als een zwak zuur; maar het is bijtend en kan de huid aanraken.
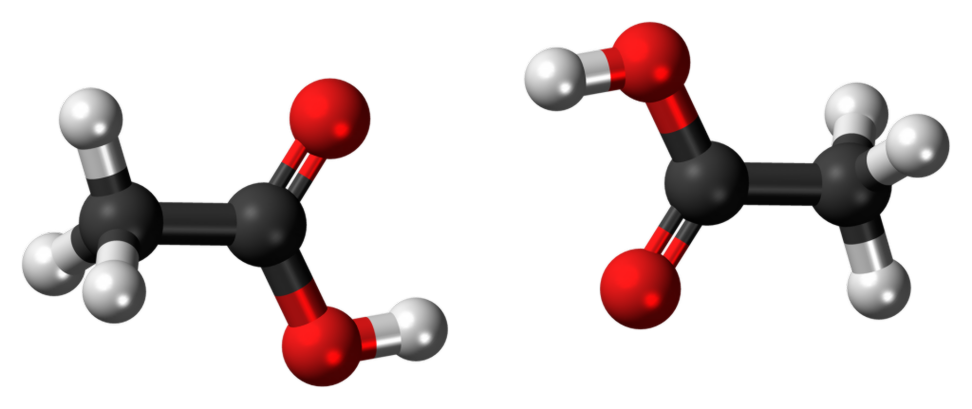
Wat is het verschil tussen Ethanol en Ethaanzuur?
Kenmerken van Ethanol en Ethaanzuur:
Functionele Groep:
Ethanol: Hydroxylgroep (-OH groep) is de functionele groep in ethanol. Het is de kenmerkende eigenschap van alcoholen. Alle alcoholen hebben tenminste een -OH groep in hun structuur.
Ethaanzuur: De functionele groep in ethaanzuur is een -COOH-groep. Het is gebruikelijk voor alle carbonzuren.
Eigenschappen:
Ethanol: Ethanol is een eenwaardige alcohol met een zoete geur die kookt bij 78. 5 ° C. Het is de enige koolwaterstof die in alle verhoudingen in water oplost.Ethanol reageert met alkalisch KMnO4 om ethaanzuur te geven, terwijl ethaanzuur niet reageert met alkalische KMnO4.
Ethaanzuur: Het is een zwak monoprotisch zuur in waterige oplossing (pKa = 4, 76). Vloeibare azijnzuur is een polair oplosmiddel zoals water. Het lost zowel polaire vloeistoffen als suikers en zouten op, en niet-polaire vloeistoffen, zoals oliën en elementen zoals zwavel en jodium. Het is gemakkelijk en volledig mengbaar met water chloroform en hexaan. Zuurzuur heeft een sterke scherpe geur.
Gebruik:
Ethanol: Ethanol is aanwezig in alcoholische dranken en wordt ook gebruikt als biobrandstof voor auto's. Het is een goed oplosmiddel dat veel organische oplossingen kan oplossen die onoplosbaar zijn in water. Ethanol wordt gebruikt om veel parfums, cosmetica en lakken in de verfindustrie te vervaardigen.
Ethanol als brandstof:
CH 3 CH 2 OH + 3O 2 → 2CO 2 + 3H 2 O
Ethaanzuur: Azijnzuur wordt gebruikt als chemisch reagens om andere chemicaliën te produceren. Het wordt in grotere hoeveelheden gebruikt om vinylacetaatmonomeer te produceren; Vinylacetaat kan gepolymeriseerd worden om polyvinylchloride of andere polymeren te produceren. Bovendien wordt azijnzuur gebruikt om esters te produceren die worden gebruikt in inkten, schilderijen en coatings. Azijnzuuranhydride is een andere belangrijke chemische verbinding die kan worden gesynthetiseerd door twee moleculen azijnzuur te condenseren. Een kleine hoeveelheid ethaanzuur wordt gebruikt om huishoudelijke azijn te produceren.
Zuurstof:
Ethanol: Ethanol reageert niet met Natriumbicarbonaat (NaHCO3), noch verandert de kleur van een blauw litmus papier. Daarom is het minder zuur dan ethaanzuur.
Ethaanzuur: Ethaanzuur is een zwak zuur dat reageert met natriumbicarbonaat (NaHC03) dat CO2-gas vrijlaat. Ook wordt het blauwe lakmoes in rood.
Image Courtesy: "Ethanol-3D-ballen". (Public Domain) via Wikimedia Commons "Acetic acid dimer 3D ball" van Jynto (talk) - Eigen werk. (CC0) via Wikimedia Commons


