Verschil tussen EDTA en EGTA
EDTA versus EGTA
EDTA en EGTA zijn beide chelaatmiddelen. Beiden zijn polyamino carbonzuren en hebben ongeveer dezelfde eigenschappen.
EDTA
EDTA is de verkorte naam voor ethyleendiamine tetraazijnzuur. Het staat ook bekend als (ethyleen dinitrilo) tetraazijnzuur. Hierna volgt de structuur van EDTA.
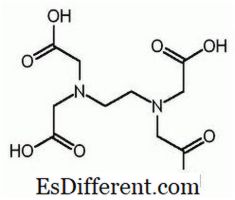
Het EDTA-molecuul heeft zes plaatsen waar een metaalion gebonden kan worden. Er zijn twee aminogroepen en vier carboxylgroepen. De twee stikstofatomen van aminogroepen hebben elk een ongegronde elektronenpaar. EDTA is een hexadentaatligand. Ook is het een chelaatmiddel als gevolg van het vermogen om metalen ionen te sequesteren. EDTA vormt chelaten met alle kationen behalve alkalimetalen en deze chelaten zijn voldoende stabiel. De stabiliteit vloeit voort uit de verschillende complexerende plaatsen in het molecuul, dat leidt tot een kooiachtige structuur die het metaalion omringt. Dit isolateert het metaalion uit oplosmiddelmoleculen, waardoor solvatie wordt voorkomen. De carboxylgroep van EDTA kan dissonerende protonen doneren; daarom heeft EDTA zure eigenschappen. De verschillende EDTA soorten worden afgekort als H 4 Y, H 3 Y - , H 2 Y 2-, HY3 - en Y 4- . Bij zeer lage pH (zuur medium) is de geprotoneerde vorm van EDTA (H 4 Y) overheersend. In contrast, bij hoge pH (basismedium) domineert volledig gedeprotoneerde vorm (Y 4- ). En als de pH verandert van lage pH tot hoge pH, overheersen andere vormen van EDTA bij bepaalde pH-waarden. EDTA is beschikbaar als volledig geprotoneerde vorm of zoutvorm. Dinatrium EDTA en calcium dinatrium EDTA zijn de meest voorkomende zoutvormen beschikbaar. Het vrije zuur H 4 Y en het dihydraat van het natriumzout Na 2 H 2 Y. 2H 2 O zijn in de handel verkrijgbaar in reagentekwaliteit.
EGTA EGTA is de verkorte term voor ethyleenglycoltetraazijnzuur. Het is een chelaatmiddel, en zeer vergelijkbaar met EDTA.EGTA heeft een hogere affiniteit voor calciumionen dan magnesiumionen. EGTA heeft de volgende structuur.
Vergelijkbaar met EDTA heeft EGTA ook vier carboxylgroepen, die vier protonen kunnen produceren bij dissociatie. Er zijn twee aminogroepen en de twee stikstofatomen van aminogroepen hebben elk elektronisch paar in elkaar verdeeld. EGTA kan als buffer gebruikt worden om op de pH van een levende cel te lijken. Deze eigenschap van EGTA maakt het gebruik ervan mogelijk in Tandem Affinity Purification, een eiwitzuiveringstechniek.

Wat is het verschil tussen


