Verschil tussen ammoniumnitraat en ureum
Ammoniumnitraat versus ureum
Verbindingen die stikstof bevatten worden vaak gebruikt als meststof omdat stikstof een van de zeer essentiële elementen is voor plantengroei en ontwikkeling. Ammoniumnitraat en ureum zijn zulke stikstofbevattende vaste stoffen.
Ammoniumnitraat
Ammoniumnitraat heeft de chemische formule van NH 4 NO 3 . Dit is het nitraat van ammoniak, en het heeft de volgende structuur.

Bij kamertemperatuur en standaarddruk bestaat ammoniumnitraat als een geurloze witte kristallijne vaste stof. Dit is een zure zout met een pH van ongeveer 5. 4. De molmassa bedraagt 80, 052 g / mol. Smeltpunt van ammoniumnitraat is ongeveer 170 ° C en ontleding wanneer het verwarmd wordt tot ongeveer 210 o C. Ammoniumnitraat wordt voornamelijk gebruikt voor landbouwdoeleinden. Het is rijk aan stikstof, dus wordt het als kunstmest gebruikt om stikstof aan planten te leveren. Aangezien het direct contact met chemische stoffen niet gevaarlijk is en de toxiciteit ervan minder is, is het gunstig om te gebruiken als meststof. Bovendien zorgt verwarming of ontsteking dat ammoniumnitraat ontploft. Daarom wordt het gebruikt als oxidatiemiddel in explosieven. Vanwege deze explosieve aard moeten we bij het opslaan van ammoniumnitraat extra voorzichtig zijn. Ammoniumnitraat is stabiel, maar wanneer het in de gesmolten toestand is, is het risico op explosie hoger. Het risico neemt toe bij contact met oxiderende materialen zoals olie, diesel, papier, lap of stro. De productie van ammoniumnitraat is een eenvoudige chemische reactie. Wanneer salpeterzuur met ammoniakvloeistof wordt gereageerd, wordt ammoniumnitraat in de oplosvorm gevormd. Industriaal geconcentreerd salpeterzuur en ammoniakgas worden gebruikt voor de productie. Aangezien dit een zeer exothermische en hevige reactie is, is het uitdagend om het op grote schaal te produceren. Ammoniumnitraat is zeer zout in water. Daarom, wanneer het als kunstmest wordt gebruikt, kan afgewassen worden en opgevuld worden in waterlichamen. Dit kan een fatale voorwaarde zijn voor het aquatische leven.
Urea Ureum heeft de moleculaire formule van CO (NH
2 ) 2 en de volgende structuur. Het is een carbamide met de functionele groep C = O. Twee NH
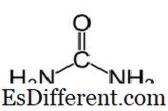
2 groepen zijn gebonden aan de carbonyl koolstof van twee kanten. Urea wordt natuurlijk geproduceerd bij zoogdieren in stikstofmetabolisme. Dit staat bekend als de ureumcyclus, en oxidatie van ammoniak of aminozuren produceert ureum in onze lichamen. Het grootste deel van de ureum wordt uitgescheiden door de nieren met urine, terwijl sommige met zweet uitgescheiden worden. De hoge wateroplosbaarheid van ureum is handig bij het uitscheiden van het lichaam. Ureum is een kleurloze, geurloze vaste stof, en het is niet giftig. Anders dan een metabolisch product, is het voornaamste gebruik om kunstmest te produceren.Ureum is een van de meest voorkomende stikstofvrije meststoffen, en heeft een hoge stikstofgehalte in vergelijking met andere vaste stikstofhoudende meststoffen. In de bodem wordt ureum omgezet in ammoniak en kooldioxide. Deze ammoniak kan worden omgezet in nitriet door bodembacteriën. Verder wordt ureum gebruikt om explosieven zoals ureumnitraat te produceren. Het wordt ook gebruikt als grondstof om chemicaliën zoals kunststoffen en lijmen te produceren.



