Verschil tussen alifatische en aromatische aminen | Alifatische vs Aromatische Aminen
Alifatische vs Aromatische Aminen
Het beste en het belangrijkste verschil tussen alifatische en aromatische aminen is het structurele verschil tussen de twee verbindingen. Alifatische aminen zijn de amineverbindingen waarin stikstof aan alleen alkylgroepen is gebonden, en aromatische aminen zijn de amineverbindingen waarin stikstof aan ten minste één van de arylgroepen is gebonden. Dit structurele verschil leidt tot alle andere verschillen in hun eigenschappen, zoals reactiviteit, zuurheid en stabiliteit.
Wat zijn alifatische aminen?
In alifatische aminen wordt stikstof rechtstreeks gebonden aan alleen alkylgroepen en waterstofatomen . Het aantal alkylgroepen varieert van een tot drie. Afhankelijk van het aantal toegevoegde alkylgroepen worden ze primaire aminen genoemd (alleen één alkylgroep -1 o ), " secundaire aminen " (twee alkylgroepen - 2 o ) en " tertiaire aminen " (drie alkylgroepen - 3 o ).
Alle alifatische aminen zijn zwakke basen zoals ammoniak, maar ze zijn licht sterkere basen dan ammoniak. Ze hebben allemaal bijna dezelfde basissterkte van Pkb = 3-4. De basisheid neemt toe als de waterstofgroepen op stikstofatoom worden vervangen door alkylgroepen. Tertiaire aminen zijn meer basis dan primaire en secundaire aminen.
Wanneer stikstof een van de atomen in een ring is, worden ze heterocyclische aminen genoemd. Piperidine en Pyrollidine zijn twee voorbeelden voor alifatische heterocyclische aminen.
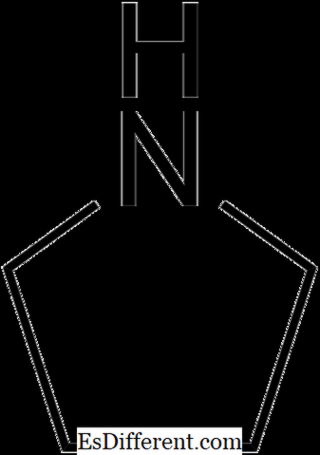
Pyrollidine
Wat zijn aromatische aminen?
In aromatische aminen, Stikstof is direct aan tenminste één benzeenring gehecht. Afhankelijk van het aantal groepen dat aan het stikstofatoom is gehecht, worden ze geclassificeerd als "primaire", "secundaire" en "tertiaire" aminen. " Arylaminen " is een andere naam voor aromatische aminen. Vergelijkbaar met alifatische aminen kunnen primaire en secundaire aromatische aminen intermoleculaire waterstofbindingen vormen. Daarom zijn kookpunten van primaire en secundaire aminen relatief hoger dan de tertiaire aminen.
Er zijn heterocyclische aromatische aminen ; pyrrol en pyrydine zijn twee voorbeelden voor hen.

Pyrydine
Wat is het verschil tussen alifatische en aromatische aminen?
• Structuur:
• Alkylaminen bevatten geen benzeenringen die direct aan stikstofatoom zijn verbonden.
• Maar in aromatische aminen is er tenminste één benzeenring direct verbonden aan het stikstofatoom.
• Alifatische aminen kunnen aromatische ringen hebben, zolang stikstof direct aan een koolstofatoom is bevestigd.
• Basis:
• Alifatische aminen zijn sterkere basen dan aromatische aminen. Dit komt hoofdzakelijk door de stabiliteit van de kation die na de ionisatie vormt. Met andere woorden, alkylammoniumionen zijn stabieler dan arylammoniumionen. Omdat alkylgroepen elektronenvrijmakende groepen zijn en derhalve de positieve lading op het stikstofatoom gedeeltelijk verdelen.

• Alifatische heterocyclische aminen zijn ook sterkere basen dan aromatische heterocyclische aminen.
• Voorbeelden
• Voorbeelden voor alifatische heterocyclische aminen zijn Piperidine en Pyrollidine.
• Voorbeelden voor heterocyclische aromatische aminen zijn pyrrol en pyrydine.
Afbeeldingen Hoffelijkheid: Pyrollidine en Pyridine via Wikicommons (Publiek domein)




