Verschil tussen octet en duplet | Octet vs Duplet
Belangrijkste verschil - Octet vs Duplet
Er zijn chemisch actieve en inactieve atomen of verbindingen aanwezig in de natuur. Dit kenmerk is voornamelijk afhankelijk van het aantal elektronen aanwezig in de buitenste schelpen van de atomen. Atomen met onvolledige schelpen kunnen actief worden om hun elektronconfiguratie te voltooien om stabiel te worden. Atomen die inactief zijn, hebben een volledige elektronische configuratie; dus reageren deze atomen niet met elk ander atoom, tenzij in speciale omstandigheden. Edele gassen zijn altijd inactief in de natuur. Vandaar dat ze bekend staan als inerte gassen. Inerte gassen bevinden zich in de achtste kolom in de periodieke tabel. Andere elementen in dezelfde periode (rij) hebben de neiging om de elektronconfiguratie van het inerte gas te verkrijgen aan het eind van die periode, wat de meest stabiele vorm van aard is. Actieve atomen hebben de neiging om het aantal elektronen te voltooien volgens octetregel of dubbele regel . Het belangrijkste verschil tussen octet en duplet is dat octet een atoom of ion is met maximaal acht elektronen in de buitenste schaal terwijl dubbele is een atoom met maximaal twee elektronen in de buitenste schaal.
INHOUD
1. Overzicht en sleutelverschil
2. Wat is een Octet
3. Wat is een Duplet
4. Side by Side Vergelijking - Octet vs Duplet
5. Samenvatting
Wat is een Octet?
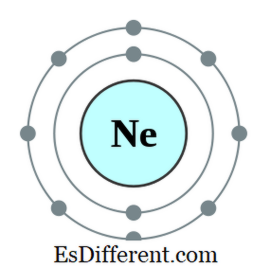
Een octet is een atoom of een ionen met acht elektronen in de buitenste schaal van dat atoom. Alle edele gassen behalve helium hebben acht elektronen en zijn inert in de natuur. De elektronconfiguratie van een edelgas zal altijd als volgt eindigen.
2 np 6 De elektronconfiguratie van Neon is bijvoorbeeld 1s
2 2s 2 2p 6 . Neon is een inert gas. Andere elementen met zeven, zes, enz. Elektronen in de buitenste orbitaal hebben de neiging om de octetregel te gehoorzamen door elektronen van buiten te verkrijgen; sommige andere elementen die een, twee, enz. hebben, hebben elektronen de neiging om elektronen te verliezen en de elektronconfiguratie van het dichtstbijzijnde inerte gas te verkrijgen. Maar andere elementen in het midden van de periodieke tabel zullen nieuwe bindingen vormen met elementen die overmaat elektronen hebben om die elektronen te delen en een octet te worden.
Wat is een Duplet?
Waterstofatoom en heliumatoom zijn de kleinste elementen in de natuur en hebben maar één orbitaal om hun kern. Deze orbitaal heet 1s orbitaal. Deze orbitaal kan maximaal twee elektronen bevatten. Waterstofatoom heeft één elektron en helium heeft twee elektronen. Vandaar, helium heet een duplicaat.Helium heeft het maximale aantal elektronen dat het kan hebben; dus het is een stabiel element in de natuur. Daarom is Helium ook een inert gas. Maar waterstof heeft maar één elektron en het enige orbitaal dat het heeft is onvolledig. Aldus is alleen waterstofatoom zeer reactief en heeft het de neiging om een covalente binding te vormen met een ander waterstofatoom door de enige elektronen te delen die ze hebben. Dan worden deze waterstofatomen duplicaten, omdat ze nu twee elektronen in hun buitenste orbitals hebben. Maar Lithium kan ook gedragen als een duplicaat door het elektron uit zijn buitenste orbitaal te verwijderen. De elektronenconfiguratie van lithium is 1s
2 2s 1 . Door het 2s 1 elektron te verwijderen, kan het een duplicaat worden. In dat geval zijn He, H - en Li + duplicaten die kunnen bestaan als stabiele duplicaten. Alle duplicaten hebben een elektronconfiguratie die als volgt eindigt.
ns
2 Figuur 02: Helium, een dubbele

Wat is het verschil tussen Octet en Duplet?
- diff Artikel Midden voor tafel ->
Octet vs Duplet
Octet heeft acht elektronen in de buitenste schaal. |
|
| Duplet heeft twee elektronen in de buitenste schaal. | Common Electron Configuration |
| Octet heeft ns | |
| 2 np 6 type elektronconfiguratie aan het einde. Duplet heeft ns | 2 type configuratie aan het einde. Aantal orbitalen |
| Octet kan minimaal twee orbitalen bevatten. | |
| Een duplicaat heeft slechts één orbitaal. | Type orbitalen |
| Een octet kan alle soorten orbitalen hebben, zoals s, p, d, f, enz. | |
| Duplet heeft alleen s orbitaal. | Samenvatting - Octet vs Duplet |
Alle elementen hebben de neiging om stabiel te worden. Maar met onvolledige elektronenconfiguraties kunnen atomen niet stabiel zijn; Zo worden ze zeer reactief om de schelpen met elektronen te vullen door elektronen te verwerven, te verliezen of te delen. De atomen of moleculen die de octet of de dubbele regel gehoorzamen zijn stabiel. Het belangrijkste verschil tussen octet en duplet is dat octet acht elektronen heeft in zijn buitenste orbitaal, terwijl duplicaat twee elektronen in zijn orbitaal heeft.
Referenties:
1. Nema, P., 2011. Topperlearning. [Online] Beschikbaar op: // www. topperlearning. com / forums / home-work-help-19 / wat-is-octet-duplet-valentie-en-ionen-chemie-structuur-van-het-atoom-46317 / antwoord [Toegang tot 29 05 2017].
2. Chang, R., 2010. Chemie. 10e ed. New York: McGraw-Hill.
3. Anon., 2015. Grade stacker. [Online] Beschikbaar op: // gradestack. com / NTSE-Complete-Course / Chemical-Bonding / Chemical-Activity-of-An / 19176-3853-37737-studie-wtw [Toegang tot 29 05 2017].
Image Courtesy:
1. "Electron shell 002 Helium - no label" Door Pumbaa (originele werk van Greg Robson) - Elektronische schelpdiagrammen (bijbehorende gelabelde versie) (CC BY-SA 2. 0 uk) via Commons Wikimedia
2. "Electron shell 010 Neon" Door Pumbaa (originele werk van Greg Robson) (CC BY-SA 2. 0 uk) via Commons Wikimedia