Verschil tussen monatomische en diatomische | Monatomische vs Diatomische
Verschil tussen monatomische en diatomische is voornamelijk met betrekking tot de aanwezige atomen in de soort. Zoals de namen suggereren, staan beide termen voor verschillende staten van atoomverenigingen waar 'mono' betekent 'een' en 'di' betekent 'twee'. 'Dus, gewoon, monomatiek betekent een'
een atoom 'en diatomisch betekent' twee atomen. ' Er kunnen echter zo veel verschillende variaties zijn aan deze basisdefinitie.
Wat is Monatomic?Wanneer
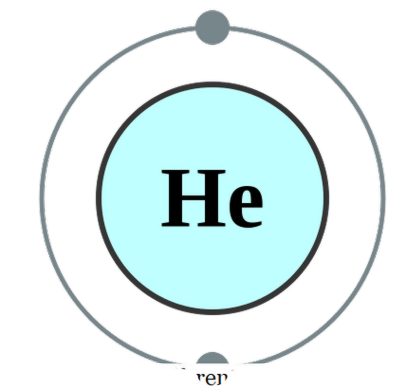
op zichzelf een enkel atoom bestaat (dat is zelden het geval), noemen we het monomatiek. Dit betekent dat de elementen in hun pure enkelvoud zijn. Het enige praktische voorbeeld dat onder deze categorie valt, zijn de edele gassen die alleen als atomen bestaan, omdat ze hun buitenste schaal hebben voltooid met een octet van elektronen. Ze kijken er daarom niet naar om meer elektronen te accepteren of te doneren om stabieler te zijn. Daarom zijn edele gassen stabiel in monatomische vorm. Enkele voorbeelden zijn: Hij - Helium, Ne - Neon, Ar - Argon, Xe - Xenon, Kr - Krypton, Rn - Radon.
Wat is diatomisch?
Wanneer
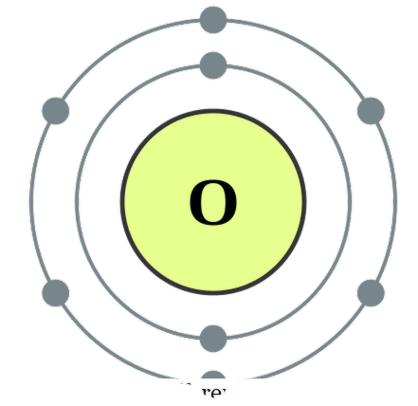
twee atomen in elkaar zijn , noemen we het diatomisch. Deze atomen kunnen van hetzelfde type of verschillend zijn. Als ze twee gelijkaardige atomen zijn, noemen we het ' homonucleaire diatomen ' en als ze van verschillende soorten zijn gemaakt, noemen we het ' heteronucleaire diatomen '. Voorbeelden voor sommige homonucleaire diatomen zouden O2, N2, H2, enz. Zijn, terwijl CO, NO, HC1, enz. Kunnen worden gegeven als voorbeelden voor heteronucleaire diatomen. Zuurstof
Diatomen kunnen als verbindingen worden beschouwd als zij deze verenigingen vormen om meer stabiliteit te bereiken door elektronen met elkaar te delen, zodat beide atomen elektronische configuratie van edelgas bereiken. Ze kunnen door covalente bindingen binden door de overlapping van atoomorbitalen of anders kunnen ze ionische bindingen tussen hen vormen die een aantrekkingskracht tussen een positief geladen soort en een negatief geladen soort zijn. Voorbeelden voor covalente bindingen tussen diatomen omvatten CO, NO, enz. En HC1 kan worden beschouwd als een soort met ionisch aantrekkings karakter. Aangezien de aantrekkingskracht tussen H + en Cl- niet erg sterk is, is het echter niet een heel goed voorbeeld voor ionische bindingen die een ander bepaald onderwerp is.
Wat is het verschil tussen monatomische en diatomische?
• Monatomische soorten hebben één atoom, terwijl diatomische soorten twee atomen hebben.
• Monatomische soorten zijn over het algemeen niet stabiel, maar diatomische soorten zijn over het algemeen stabiel.
• Edelgassen zijn alleen monomatiek en worden niet gevonden in diatomische vorm.
• Er bestaan chemische bindingen tussen diatomische soorten, terwijl er geen bindingen zijn in monatomische soorten.
Foto's Gerechtigheid:
Helium elektron configuratie door Pumbaa (CC BY-SA 2. 0 uk)
- Zuurstof elektronen configuratie door DePiep (CC BY-SA 3. 0)



