Verschil tussen isotonisch en hypertonisch | Isotonisch vs Hypertonisch
Hoofdverschil - Isotonisch vs Hypertonisch
Het is belangrijk om het concept van Tonicity te begrijpen alvorens het verschil tussen isotonisch en hypertonisch te analyseren. Laat ons daarom eerst het concept van toniciteit en het belang daarvan kort omschrijven. Toniciteit is de variantie in waterconcentratie van twee oplossingen gedeeld door een semipermeabel membraan. Het kan ook uitgelegd worden als de relatieve waterconcentratie van oplossingen die de richting en de hoeveelheid diffusie van water bepalen tot het gelijke concentraties aan beide zijden van het membraan bereikt. Door de toniciteit van oplossingen te identificeren, kunnen we bepalen in welke richting water zal diffunderen. Dit fenomeen wordt vaak gebruikt bij het illustreren van de respons van cellen die ondergedompeld zijn in een externe oplossing. Er zijn drie classificaties van toniciteit die één oplossing relatief ten opzichte van een andere kan hebben. Zij zijn hypertonisch, hypotonisch en isotonisch. Het sleutelverschil tussen isotonisch en hypertonisch is dat de hypertonische oplossing meer oplosmiddel bevat dan opgelost terwijl het oplosmiddel en oplosmiddel evenzeer in de isotonische oplossing worden verdeeld. Het memoriseren van de definitie van hypertonische en isotonische oplossingen is echter niet essentieel als we het verschil tussen isotonische en hypertonische oplossingen kunnen begrijpen.
Wat is Hypertonic?
Hyper is een ander woord voor boven of overdreven. Hypertonische oplossingen hebben een hogere concentratie opgeloste stof (glucose of zout) dan de cel. Oplosmiddelen zijn de elementen die opgelost worden in een oplosmiddel, waardoor een oplossing wordt gevormd. In een hypertonische oplossing is de concentratie opgeloste stoffen groter buiten de cel dan erin. Wanneer een cel ondergedompeld wordt in een hypertonische oplossing, zal er een osmotische verschuiving zijn en watermoleculen zullen uit de cel vloeien om de concentratie van de opgeloste stoffen te compenseren en er zal een krimp in de grootte van de cel zijn.
Wat is isotonisch?
Iso is een ander woord voor gelijke en tonic is voor de toniciteit van de oplossing. Isotonische oplossingen zullen dezelfde concentratie opgelost hebben dan de oplossing waarmee ze worden vergeleken. In een isotonische oplossing is de concentratie opgeloste stoffen hetzelfde, zowel binnen als buiten de cel, die een evenwicht creëert binnen de omgeving van de celorganisatie. Wanneer een cel onderdompeld is in een isotonische oplossing, zal er geen osmotische verschuiving zijn en watermoleculen diffunderen in beide richtingen door het celmembraan om de concentratie van de opgeloste stoffen te compenseren.Dit proces zal geen zwelling of krimp van de cel veroorzaken.

Wat is het verschil tussen isotonisch en hypertonisch?
De verschillen tussen hypertonische en isotonische kunnen in de volgende categorieën worden ingedeeld.
Definitie van Isotonisch en Hypertonisch
Hypertonisch: "hyper" staat bekend als boven of overdreven + "tonic" staat bekend als iets in de lijn van een oplossing. Dus, hypertonische suggereert verhoogde toniciteit van de oplossing.
Isotonisch: "iso" staat bekend als hetzelfde + "tonic" staat bekend als iets langs de lijn van een oplossing. Zo suggereert isotonische soortgelijke toniciteit van de oplossing.
Kenmerken van Isotonisch en Hypertonisch
Concentratie van opgeloste oplossing en oplossing
Hypertonic: Oplossing bevat meer oplosmiddel dan opgeloste stof.
Isotonisch: Solute en oplosmiddel in de oplossing worden op gelijke wijze verdeeld.
Voorbeelden
Hypertonisch: Gezuiverd water, omdat geen / minder opgeloste stof in het gezuiverde water opgelost is en de concentratie ervan zeer laag is in vergelijking met de celomgeving.
Isotonische: Zoutoplossing is een isotonisch bloedplasma voor menselijk bloed
Reactie van cellen in hypertonische en isotonische oplossing (zie figuur 1)
Hypertonic: Wanneer een biologische cel in een hypertonische omgeving, stroomt het water over het celmembraan uit de cel om de concentratie van opgeloste stoffen in beide cellen en de omgeving rond de cel te compenseren. Als gevolg daarvan zal de cel krimpen als water de cel verlaat om de hogere concentratie van opgeloste stof in de buitenomgeving te verminderen.
Isotonisch: Wanneer een cel in een isotonische oplossing is, zal het geen zwelling of krimping van de cel veroorzaken.
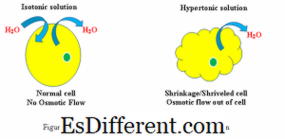
Waterconcentratiegradiënt
Hypertonic: Waterconcentratiegradiënt kan waargenomen worden van de binnenkant van de cel naar de hypertonische oplossing
Isotonisch: Waterconcentratiegradiënt bestaat niet
Solute concentratiegradiënt < Hypertonic:
Solute concentratiegradiënt wordt gezien vanuit de hypertonische oplossing aan de binnenkant van de cel Isotonisch:
Solute concentratiegradiënt bestaat niet. Osmotische verschuiving
Hypertonic:
Osmotische verschuiving bestaat. Isotonisch:
Osmotische verschuiving bestaat niet Waterbeweging
Hypertonic:
Watermoleculen verplaatsen of diffuderen snel van binnen naar de cel naar buitenoplossingsrichtlijnen, waardoor de cel water zal verliezen. Isotonisch:
Watermoleculen bewegen of diffunderen in beide richtingen, en de snelheid van waterdiffusie is in elke richting vergelijkbaar. Zo zal de cel water verkrijgen of verliezen. Sportdranken
Isotonisch:
Een isotonische drank bevat vergelijkbare concentraties zout, suiker koolhydraat en elektrolyten zoals in het menselijk lichaam. Isotonische sportdrank wordt vaak verkozen als een orale rehydratiewerk. Het heeft meestal 4-8 g koolhydraten per 100 ml. Hypertonic:
Hypertonische drank bevat hogere concentraties zout, suiker koolhydraat en elektrolyten zoals in het menselijk lichaam.Het heeft meestal ongeveer 8 g koolhydraat per 100 ml. Een hypertonische oplossing wordt ook gebruikt bij osmotherapie om hersenbloeding te beheren. Hypertonische sportdranken zijn ideaal voor degenen die een zeer hoog niveau van energie nodig hebben. Concluderend zijn er drie vormen van oplossingen die gebaseerd zijn op opgeloste concentratie en zij zijn isotonisch, hypotonisch en hypertonisch. De concentratie van opgeloste stoffen is hetzelfde binnen en buiten de cel in een isotonische oplossing. De concentratie van opgeloste stoffen is groter in de cel dan de buitenomgeving in een hypotonische oplossing, terwijl de hypertonische oplossing een is waar de concentratie van opgeloste stoffen buiten de omgeving groter is dan in de cel.
Referenties Mansoor, M. A., Beverly, J. en Sandmann. (2002). Toegepaste Fysische Apotheek. McGraw-Hill Professional. blz. 54-57. Voet, D., Judith, G. V. en Charlotte, W. P. (2001). Grondslagen van Biochemie (Rev. ed.). New York: Wiley. p. 30. Image Courtesy: "Osmotische druk op bloedcellen diagram" van LadyofHats - heeft het zelf gebaseerd op [1], [2], [3] en [4] … (Public Domain) via Wikimedia Commons.




